
| A、循环过程中需补充H2O |
| B、反应I中SO2氧化性比HI强 |
| C、反应III易在常温下进行 |
| D、循环过程中产生1molO2的同时产生1 molH2 |


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中:Na+,K+,MnO4-,SO42- |
| B、在pH=l的溶液中:Ca2+,Fe2+,Cl-,NO3- |
| C、含有HCO3-的溶液中:Na+,K+,Cl-,CO32- |
| D、在含大量的Fe3+溶液中:NH4+,Na+,Cl-,SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电化学腐蚀要比化学腐蚀普遍的多,但腐蚀速度要比化学腐蚀慢得多 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、海轮外壳连接锌块是采用牺牲阳极的阴极保护法保护外壳不受腐蚀 |
| D、地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应属于分解反应 |
| B、反应瞬间产生大量高温气体推动航天飞机飞行 |
| C、该反应主要是将化学能转变为热能和动能 |
| D、在反应中高氯酸铵只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
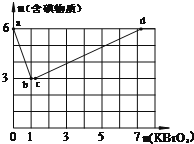 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量CO2气体通入NaClO溶液中;H++ClO-=HClO |
| B、在氯水中滴入少量NaOH溶液:Cl2+2OH-=Cl-+2HClO |
| C、在Ca(HCO3)2溶液中滴入过量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、在AgF溶液中滴入盐酸:Ag++F-+H++Cl-=AgCl↓+HF |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验小组 | 称取CuSO4的质量(g) | 装置C增加的质量(g) | 量筒中水的体积折算成标准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com