

| A. | 左边装置是氢氧燃料电池,右边装置是电镀池 | |
| B. | 电子流动方向:b→Zn→CuSO4(aq)→Cu→a | |
| C. | 一段时间后,左端溶液浓度变小,右端溶液浓度不变 | |
| D. | 左边装置中的电池反应为:2H2+O2=2H2O |
分析 左图中为原电池,a为正极,b为负极,负极b的电极反应为2OH-+H2-2e-=H2O,正极a上发生O2+2H2O+4e-=4OH-;右图为电解池,Cu与正极相连为阳极,发生Cu-2e-=Cu2+,Zn为阴极,发生电极反应为Cu2++2e-=Cu,以此来解答.
解答 解:A.由装置图可知左边装置是燃料电池,右边装置Cu为阳极,电解质溶液为硫酸铜,则是电镀池,故A正确;
B.左边是原电池,投放氢气的电极是负极,投放氧气的电极是正极,则锌是阴极,铜是阳极,装置中电子的流向量b→Zn,Cu→a,故B错误;
C.左端原电池生成水,则溶液浓度变小,右端为电镀,溶液浓度不变,故C正确;
D.正极a上发生O2+2H2O+4e-=4OH-,总的电极反应式为:2H2+O2=2H2O,故D正确.
故选B.
点评 本题考查原电池与电解池,明确电极的判断及发生的电极反应为解答的关键,注重基础知识的考查,题目难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| 铝 | 镁 | |
| A.与非金属反应 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B.与水反应 | 常温下难与水反应 | 常温下能与水缓慢反应 |
| C.与碱反应 | 能溶于碱溶液 | 能溶于碱溶液 |
| D.与某些氧化物反应 | 能与Fe2O3、MnO2、C如O3等金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧乙酸具有强氧化性,可以杀菌消毒,所以常用作消毒剂 | |
| B. | 黄瓜含有丰富的维生素C,热锅爆炒能减少维生素C的流失 | |
| C. | 向尿液中加入新制的Cu(OH)2悬浊液并加热煮沸可用于糖尿病诊断 | |
| D. | 可用燃烧的方法鉴别羊毛围巾和合成纤维围巾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2?Ca2++2OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO3?2H++SO32- | D. | BaSO4═Ba2++SO42- |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列关于溶液和胶体的叙述,正确的是( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).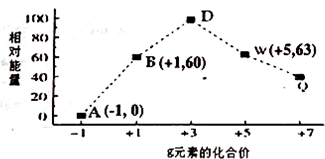
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com