
【题目】下列各组物质中,其化学键类型完全相同的是( )
A.NH3和H2O
B.HCl和KCl
C.H2O和H2O2
D.NaCl和NaOH
科目:高中化学 来源: 题型:
【题目】在日常生产生活中,我们会遇到各种各样的化学反应。下列反应属于氧化还原反应的是
A. 用天然气(主要成分为CH4)逐步代替煤气作为燃料
B. 用无水硫酸铜(CuSO4)检验工业酒精中是否含有少量的水
C. 将生石灰(CaO)投入水中,即可得到建筑用的熟石灰[Ca(OH)2]
D. 碳铵(NH4HCO3)是一种常用的化肥,应保存于阴凉处,因为在较高温度下,它会分解生成氨气、水和二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
C. 使甲基橙变红的溶液中:Fe2+、MnO4﹣、Na+、SO42﹣
D. 通入大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 足量锌与一定量浓H2SO4反应生成0.5mol气体,反应中转移的电子数为NA
B. 1L 0.1mol/L的CH3COOH溶液中含有H+的数目约为0.1 NA
C. 电解精炼铜(粗铜中含有锌、铁、银等杂质),电路中有2NA个电子通过时,阴极增重64g
D. 常温常压下,1.8 g甲基(-CD3)中含有的电子数为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
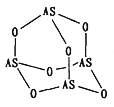
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
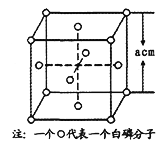
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求做答
(1)甲烷(CH4)的摩尔质量为_________。
(2)0.5mol H2的质量为______,标准状况下该气体的体积为_________。
(3)5molCO2所含氧原子的数目为__________个。
(4)100mL0.25mol/L Na2SO4溶液中Na+的物质的量浓度是__________mol/L。
(5)有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl﹣)为1.6mol/L,则Al3+的物质的量浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷与Cl2的取代反应所得四种有机产物的说法不正确的是( )
A.都是有机物B.都不溶于水
C.有一种气态物质,其余均是液体D.均是正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气, 放出256.64kJ的热量。
(1)写出该反应的热化学方程式
(2)已知H2O (l) = H2O(g) △H= + 44 kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的 优点
(4)已知N2(g)+2O2(g)=2 NO2(g) △H= +68 kJ·mol-1, N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质的比较中,正确的是( )
A.电子层数:P<S<Cl
B.最高正化合价:N<O<F
C.原子半径:C<N<O
D.金属性:Na>Mg>Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com