
| A. | 4:5 | B. | 5:3 | C. | 5:6 | D. | 6:5 |
分析 根据碳守恒分析求解,也就是求C 原子个数比,对于5L相同物质的量的甲烷和丙烷的混和气体相当于C原子个数:2.5×1+2.5×3=10,C2H4 、C3H6相同质量,则物质的量之比3:2,C原子个数:5×$\frac{3}{5}$×2+5×$\frac{2}{5}$×3=12,由此分析解答.
解答 解:根据碳守恒分析求解,也就是求C 原子个数比,对于5L相同物质的量的甲烷和丙烷的混和气体相当于C原子个数:2.5×1+2.5×3=10,C2H4 、C3H6相同质量,则物质的量之比3:2,C原子个数:5×$\frac{3}{5}$×2+5×$\frac{2}{5}$×3=12,所以所生成的二氧化碳质量之比为10:12=5:6,故选C.
点评 本题考查有机物燃烧的有关计算,根据分子组成,结合C元素守恒是解答关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
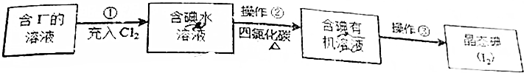
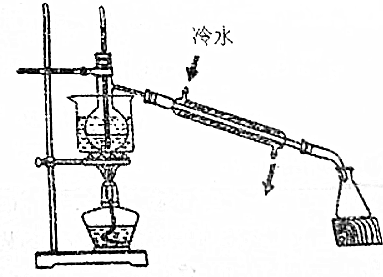
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸,加热一段时间后再加入银氨溶液,水浴加热,检验淀粉是否水解 | |
| B. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛 | |
| C. | 制硝基苯时,将盛有混合液的试管加热,控制温度100-110℃ | |
| D. | 要鉴别己烯中是否混有甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压,完全燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | |
| C. | 所含共用电子对数目为($\frac{a}{7+1}$)NA | |
| D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
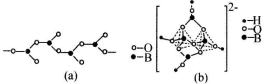
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com