
| A. | 只有第ⅡA族元素的原子最外层有2个电子 | |
| B. | L电子层为奇数的所有元素都是非金属 | |
| C. | 第三、四、五、六周期元素的数目分别是18、18、32、32 | |
| D. | 由左至右第8、9、10三列元素中没有非金属元素 |
分析 A.He原子及不少过渡元素的最外层含有2个电子;
B.L电子层为奇数的元素不一定为非金属,如Li;
C.第3、4、5、6周期元素的数目分别是8、18、18、32;
D..8、9、10三列元素属于过渡元素,都是金属元素.
解答 解:A.原子最外层含有2个电子的不一定为ⅡA族元素,也可能为He原子或过渡元素原子,故A错误;
B.L电子层为奇数的元素只能是第二周期元素,其中Li为金属,故B错误;
C.第三周期含有8种元素,第五周期含有18种元素,故C错误;
D.由左至右第8、9、10三列元素为ⅤⅢ族元素,属于过渡元素,都是金属元素,没有非金属元素,故D正确;
故选D.
点评 本题考查了元素周期表结构及应用,题目难度不大,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期表的关系,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:多选题
| A. | M=WNA | B. | M=$\frac{16w}{b}$ | C. | M=$\frac{w}{16b}$ | D. | M=$\frac{w}{{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X溶液 | 固体Y |  |
| A | 浓硫酸 | 铜粉 | |
| B | 浓氨水 | CaO | |
| C | 稀盐酸 | 石灰石 | |
| D | 浓盐酸 | 高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
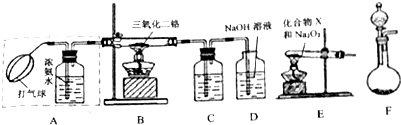
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-FeCl2-FeCl3-Fe(OH)3 | B. | Al-Al2O3-Al(OH)3-NaAlO2 | ||
| C. | S-SO3-H2SO4-MgSO4 | D. | N2-NO2-NO-HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 苯酚钠溶液中通入少量CO2 | 产生白色浑浊 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B | 在少量稀碳酸钠溶液中逐滴加入稀盐酸至过量. | 开始无气泡,后来有气泡. | CO32-+H+→HCO3- HCO3-+H+→CO2↑+H2O |
| C | 将过量氯化铝溶液逐滴加入到氢氧化钠溶液中 | 先产生白色沉淀而后逐渐溶解 | Al3++3OH-→Al(OH)3↓ Al(OH)3+OH-→AlO2-+H2O |
| D | 向含有酚酞的氢氧化钡溶液中滴加稀硫酸 | 产生白色沉淀,溶液由红色变成无色. | Ba2++OH+H++SO42-→BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中四种粒子之间满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中粒子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质为:NH3•H2O和NH4Cl | |
| C. | 若溶液中粒子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质只有NH4Cl | |
| D. | 若溶液中c(NH4+)=c(Cl-),则该溶液pH等于7. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com