
| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是H+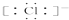 | |
| C. | HCl的结构式是H-Cl | |
| D. | NaCl熔化时破坏共价键 |
科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | 2H2S+SO2=3S+2H2O | D. | Cl2+2NaOH=NaCl+NaClO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
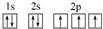 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2008年北京奥运会火炬以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷.下列说法不正确的是( )
2008年北京奥运会火炬以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷.下列说法不正确的是( )| A. | 丙烷与甲烷互为同系物 | |
| B. | 丙烷燃烧是吸热反应 | |
| C. | 铝柄有一层致密的氧化膜可防止其腐蚀 | |
| D. | 火炬燃料用丙烷比用煤油更环保 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )| A. | 图中属于烷烃的是A、C、H | |
| B. | 图中C和F分子中氢原子数相同 | |
| C. | 图中物质碳元素的质量分数最大的是C | |
| D. | 图中与B互为同分异构体的有E、F、H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有5种 | |
| B. | 反应2H2(g)+O2(g)═2H2O(l)变化过程中,熵在减小(即△S<O) | |
| C. | 乙烯和1,3-丁二烯的混合气体1 L,催化剂存在下与足量氢气发生加成反应,消耗1.4 L氢气,则原混合气体中乙烯和1,3-丁二烯的体积比为:3:2 | |
| D. | 可用氢氧化钠溶液、银氨溶液和碘水检验淀粉溶液是否是部分发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com