
由下列元素在周期表中的位置,给出元素原子的价电子排布式。
(1)第4周期ⅥB族;(2)第5周期ⅠB族;(3)第5周期ⅣA族;(4)第6周期ⅡA族;(5)第4周期ⅦA族。
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)强电解质溶液的导电性比弱电解质溶液的导电性强( )
(2)BaSO4投入水中, 导电性较弱,故它是弱电解质( )
(3)弱电解质溶液中存在两种共价化合物分子( )
(4)强电解质都是离子化合物,弱电解质都是共价化合物( )
(5)CaO是强电解质,是因为它的水溶液能导电( )
(6)Cl2的水溶液能导电,所以Cl2是电解质( )
查看答案和解析>>
科目:高中化学 来源: 题型:
镇痉药物C、化合物N以及高分子树脂(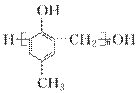 )的合成路线如下:
)的合成路线如下:
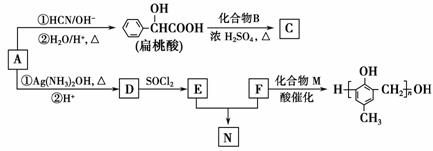
已知:RCHO
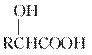
RCOOH
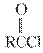
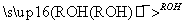 RCOOR′(R、R′代表烃基)
RCOOR′(R、R′代表烃基)
(1)A的含氧官能团的名称是________。
(2)A在催化剂作用下可与H2反应生成B。该反应的反应类型是________。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是____________________________。
(4)A发生银镜反应的化学方程式是__________________________________________________________________________________________________________________________________________。
(5)扁桃酸( )有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有________种,写出其中一种含亚甲基(—CH2—)的同分异构体的结构简式______________________。
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有________种,写出其中一种含亚甲基(—CH2—)的同分异构体的结构简式______________________。
(6)F与M合成高分子树脂的化学方程式是__________________________。
(7)N在NaOH溶液中发生水解反应的化学方程式是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第2周期元素
B.位于周期表第3周期ⅢA族的元素
C.原子最外电子层排布式为2s22p6的元素
D.原子最外电子层排布式为3s23p5的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,推测此元素在周期表中的位置为( )
A.第8周期ⅢA族 B.第6周期ⅤA族
C.第7周期ⅣB族 D.第7周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)质量数为37的氯原子符号为________。
(2)S2-的结构示意图________。
(3)氮原子的电子式________,N2的电子式________,NH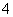 的电子式________。
的电子式________。
(4)磷原子的核外电子排布式___________________________________________,
外围电子排布式___________________________________________________,
外围电子轨道表示式______________________________________________________。
(5)按要求用三种化学用语表示基态铁原子和三价铁离子。
| Fe | Fe3+ | |
| 原子(或离子)结构示意图 | ||
| 电子排布式 | ||
| 轨道表示式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p轨道有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p轨道的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置测定中和热的实验步骤如下:
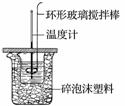
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________________。
(2)倒入NaOH溶液的正确操作是__________(填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
(6)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com