
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。其中一种流程如下:
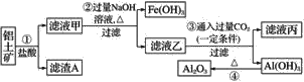
(1)写出步骤②③④中所发生主要反应的化学方程式。
步骤②____;
步骤③____;
步骤④____。
(2)若向滤渣A与适量氢氧化钠溶液反应后的混合物中通入适量二氧化碳气体,则产生的现象为___,对应的离子方程式为___。
【答案】AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl CO2+NaAlO2+2H2O═Al(OH)3↓+NaHCO3 2Al(OH)3![]() Al2O3+3H2O 生成白色胶状沉淀 SiO32-+H2O+CO2=CO32-+H2SiO3↓
Al2O3+3H2O 生成白色胶状沉淀 SiO32-+H2O+CO2=CO32-+H2SiO3↓
【解析】
铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3 +3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以滤渣A为不溶物SiO2;滤液甲中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子、铝离子和氢氧化钠反应生成氢氧化铁、氢氧化铝沉淀,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀的成分是氢氧化铁;滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3![]() Al2O3+3H2O,据此分析解题。
Al2O3+3H2O,据此分析解题。
(1)滤液甲中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子、铝离子和氢氧化钠反应生成氢氧化铁沉淀、氢氧化铝,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,步骤②中发生的主要反应有:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl;滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,步骤③发生的反应为;CO2+NaAlO2+2H2O═Al(OH)3↓+NaHCO3;氢氧化铝沉淀加热可以得到氧化铝,步骤④发生的反应为:2Al(OH)3![]() Al2O3+3H2O,
Al2O3+3H2O,
故答案为:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3↓+3NaCl;CO2+NaAlO2+2H2O═Al(OH)3↓+NaHCO3;2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(2)滤渣A为不溶物SiO2,与适量氢氧化钠溶液反应生成硅酸钠,向其中通入适量二氧化碳气体,产生的现象白色沉淀,对应的离子方程式为SiO32-+H2O+CO2=CO32-+H2SiO3↓,
故答案为:SiO32-+H2O+CO2=CO32-+H2SiO3↓。


科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. C生成的速率是A反应速率的2倍
B. A、B、C的浓度不再变化
C. 单位时间内生成nmol A,同时生成3nmol B
D. A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧![]() 可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
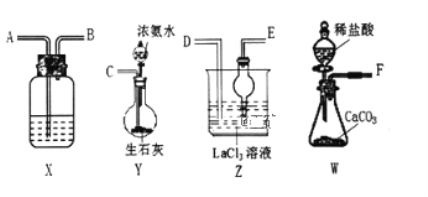
(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→_____→_____→_____→_____→_____;__________
(2)Y中发生反应的化学反应式为_______________;
(3)X中盛放的试剂是___________,其作用为___________________;
(4)Z中应先通入NH3,后通入过量的CO2,原因为__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于锌、铜和稀硫酸组成的原电池(如下图),下列说法错误的是
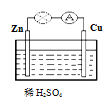
A. 负极电极反应式为Zn-2e- =Zn2+
B. 溶液中SO42-离子向负极移动
C. 电子由Zn片通过稀硫酸流向Cu片
D. 铜片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是_____________________________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________。证明炉渣中含有FeO的实验现象为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石与石墨是同素异形体。100 kPa时,1 mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是

A.石墨转化为金刚石的反应为放热反应
B.石墨比金刚石更稳定
C.金刚石比石墨更稳定
D.破坏1 mol石墨的化学键所吸收的能量小于形成1 mol金刚石的化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉与水蒸气反应的实验如图所示:
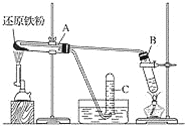
请回答下列问题:
(1)实验时,用酒精喷灯加热还原铁粉,观察到的实验现象是_________。
(2)若将C试管收集满的气体点燃,观察到的实验现象是_____________。
(3) A试管中反应的化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com