
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为 ______________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为_______________________________________________。
(1)CH3OH(l)+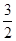 O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
(2)N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
解析试题分析:(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以1mol甲醇完全燃烧放出的热量是22.68 kJ×32=725.76 kJ,则示甲醇燃烧热的热化学方程式为CH3OH(l)+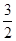 O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
(2),每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1。
考点:考查热化学方程式的书写
点评:该题是基础性试题的考查,侧重对学生基础知识的训练。该题的关键是明确热化学方程式的含义以及书写注意事项,有利于培养学生规范的答题能力,提高学生的应试能力和学习效率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年福建省漳州市七校高三第二次联考化学试卷(解析版) 题型:填空题
根据化学学科中的基本理论,请回答下列问题:
Ⅰ、常温下,取pH=2的盐酸和醋酸溶液各100 ml, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是_____ (填“A”或“B”)。

Ⅱ、丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l),△H1=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)?? △H2=-566kJ/mol
(1)写出丙烷的燃烧热的热化学方程式:???????????????????????????? 。
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g)=CO2(g)+ H2(g) △H1=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是???????????
a.体系中的压强不发生变化???????????????????? b.v正(H2)=v逆(CO)
c.混合气体的平均相对分子质量不发生变化??? d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=?????????????????? 。
③向平衡体系中充入少量CO,则平衡常数???????? (填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向????????? 极(填“正”或“负”);电池的正极电极反应为???????????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com