
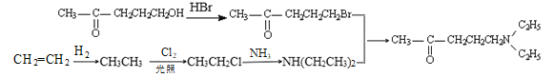
【题目】磷酸氯喹是一种抗疟疾药物,研究表明该药物对新型冠状病毒2019-nCOV有较好抑制作用,以下是该药物主体氯喹的合成路线。
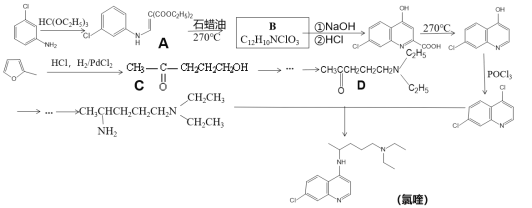
已知:①![]() 具有芳香性;
具有芳香性;
②R1-Cl+H2N-R2 → R1-NH-R2+HCl
请回答:
(1)下列说法不正确的是_________
A.氯喹具有弱碱性 B.氯喹的分子式为C18H24N3Cl
C.整个合成过程中包含了取代、加成反应 D.1molB最多可以消耗3molNaOH
(2)请写出A转化成B的化学方程式_________
(3)A转化成B的过程中还会生成一种双六元环副产物,其结构简式为_________
(4)请利用乙烯为原料将合成路线中C→D部分补充完整,用线路图表示出来(无机试剂任选)_________
(5)请写出满足下列条件的![]() 的同分异构体_________
的同分异构体_________
①1HNMR谱显示分子中只存在两种H;②分子内只存在一个环结构
【答案】BD 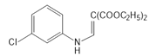
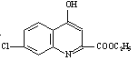 +C2H5OH
+C2H5OH 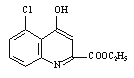
 、
、![]() 、
、![]()
【解析】
结合B的分子式以及B转化为![]() 的条件可知B为
的条件可知B为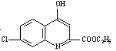 ,B发生水解反应,再酸化得到
,B发生水解反应,再酸化得到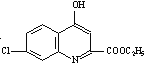 ,再结合流程中的物质转化分析解答。
,再结合流程中的物质转化分析解答。
(1)A. 氯喹分子结构中含有亚氨基和次氨基,因此具有弱碱性,故A正确;
B. 由氯喹的结构可知,其分子式为C18H26N3Cl,故B错误;
C. 整个合成过程中包含了取代、加成反应,故C正确;
D. B的结构简式为 ,其含有1个酯基,因此1molB中的酯基水解消耗1mol NaOH,另外苯环上有1个氯原子,氯原子水解得到苯酚和盐酸,然后与NaOH作用得到苯酚钠和氯化钠,则1molB中的氯原子水解最终消耗2mol NaOH,羟基消耗1mol NaOH,则1molB最多可以消耗4molNaOH,故D错误;故答案为:BD;
,其含有1个酯基,因此1molB中的酯基水解消耗1mol NaOH,另外苯环上有1个氯原子,氯原子水解得到苯酚和盐酸,然后与NaOH作用得到苯酚钠和氯化钠,则1molB中的氯原子水解最终消耗2mol NaOH,羟基消耗1mol NaOH,则1molB最多可以消耗4molNaOH,故D错误;故答案为:BD;
(2)由以上分析知,A为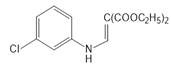 ,B为
,B为 ,同时生成C2H5OH,故反应的化学方程式为:
,同时生成C2H5OH,故反应的化学方程式为:
 +C2H5OH;
+C2H5OH;
(3)A转化成B的过程中还会生成一种双六元环副产物,由A生成B的过程可知,A中酯基碳原子也可以取代靠近Cl原子一侧的邻位上的氢原子,从而生成 ,故答案为:
,故答案为: ;
;
(4)对比C、D的结构可知,C到D应有原子团![]() 取代羟基,则
取代羟基,则![]() 与HBr先发生取代反应生成
与HBr先发生取代反应生成![]() ,乙烯与氢气发生加成反应生成乙烷,乙烷与氯气发生取代反应生成氯乙烷,氯乙烷再与氨气发生取代反应生成
,乙烯与氢气发生加成反应生成乙烷,乙烷与氯气发生取代反应生成氯乙烷,氯乙烷再与氨气发生取代反应生成![]() ,
,![]() 与
与![]() 发生取代反应生成D
发生取代反应生成D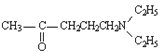 ,
,
故答案为:
 ;
;
(5)满足下列条件的![]() 的同分异构体,①1HNMR谱显示分子中只存在两种H,说明含有两种等效氢原子;②分子内只存在一个环结构,满足要求的同分异构体有:
的同分异构体,①1HNMR谱显示分子中只存在两种H,说明含有两种等效氢原子;②分子内只存在一个环结构,满足要求的同分异构体有: 、
、![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.22.4L水含原子数为NAB.18克水含水分子为NA
C.0.5摩尔H2SO4含质子数2.5 NAD.1摩尔CO32- 含电子数30NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸过程如图所示。NA为阿伏加德罗常数的值,下列说法正确的是

A.10.1gN(C2H5)3可溶于一定量盐酸形成盐,其中[N(C2H5)3H]+的数目为0.1NA
B.30g甲酸分子中,电子对数目为5 NA
C.在捕获过程中,若有22.4L CO2(标准状况)参与反应,则在反应过程中CO2分子只拆开了NA对电子对
D.该反应是氧化还原反应,每生成1mol甲酸,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。

(1)该同学应选择____ mL的容量瓶。
(2)其操作步骤如图所示,则图中操作应在下图中的____(填选项字母)之间。
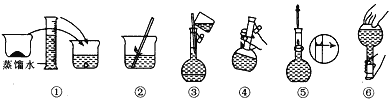
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体_____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。


(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会_______③溶液未冷却就转移入容量瓶____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaCO3质量分数为0.90的石灰石100 kg完全分解产生CO2________L(标准状况),石灰窑中该石灰石100 kg与焦炭焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的质量为__________g
(2)在25℃、101kPa的条件下,同质量的CH4和X气体的体积之比为15:8,则X的摩尔质量是_______________。
(3)两个相同体积的密闭容器X、Y,在25℃下,X中充入a gA气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取0.l molL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=9,试回答以下问题:
(1)混合溶液的pH=9的原因_____________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-) =______molL-1 ,0.1 molL-1NaOH 溶液中由水电离出的c(OH-) =______molL-1 。
(3)0.l molL-1 HA溶液与0.05 molL-1 NaOH溶液等体积混合后,pH=8,则
① 所得混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为:_________________。
② c(HA)+ c(A-)=_______ molL-1,c(HA)-c(A-)=_______molL-1。
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________7(填“>”、“<”或“=”)。
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____(填字母)。
A.NH4HCO3 B.NH4HSO4 C.NH4A D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1个氧气分子体积为 ![]() cm3
cm3
B.铜电解精炼时,当阳极质量减少64 g时,电路中转移电子数为2NA
C.标准状况下22.4 L Cl2完全溶于水时,所得溶液中含氯微粒总数为2NA
D.NaCl晶体中Na+与最近Cl-的核间距离为a cm,则其晶体密度为 ![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功合成了甲基胺离子导向的钙钛矿类杂化材料(CH3NH3)PbI3,该物质因具有较高的光电转换效率而在太阳能电池领域具有重要的应用价值。回答下列问题
(1)C、N基态原子中,第一电离能较大的是_____。
(2)CH3NH3+的电子式为_____,C、N原子的杂化轨道类型分别为______、______;CH3NH3+中,存在______(填代号)。
a.σ键 b.π键 c.配位键 d.氢键
已知甲基的供电子能力强于氢原子,则CH3NH2、(CH3)2NH中接受质子能力较强的是______。
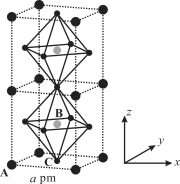
(3)(CH3NH3)PbI3的立方晶格结构如图所示,其中B代表Pb2+,则______代表 I,每个晶胞中含有I 的数目为______。原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为(1/2,1/2,1/2),则C的原子分数坐标为______。已知(CH3NH3)PbI3的晶胞参数为a pm,晶体密度为 g·cm3,设NA为阿伏加德罗常数的值,则(CH3NH3)PbI3的摩尔质量为________g·mol1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时 H2A 的pKa1=1.85,pKa2=7.19。常温下,用 0.1mol·L-1NaOH 溶封液滴定 20 mL 0.1 mol·L-1H2A 溶液的滴定曲线如图所示。下列说法不正确的是

A.A 点 V0﹤10 mL线
B.B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C.C 点所得溶液中:c(A2-)=c(HA-)
D.D 点所得溶液中:A2-水解平衡常数Kh1=10-6.81
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com