氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
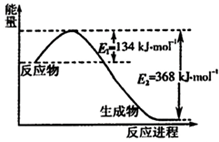
(1)如图是1mol NO
2和1mol CO反应生成CO
2和NO过程中能量变化示意图,写出NO
2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.若在反应体系中加入催化剂使反应速率增大,则E
1的变化是
减小
减小
,该反应的反应热△H
不变
不变
(填“增大”“减小”或“不变”).
(2)已知:N
2(g)+O
2(g)=2NO(g)△H=+180kJ?mol
-12NO(g)+2CO(g)=N
2(g)+2CO
2(g)△H=-746kJ?mol
-1则反应CO(g)+
O
2(g)=CO
2(g)的△H=
-283
-283
kJ?mol
-1(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生下列反应:N
2(g)+3H
2O(l)=2NH
3(g)+
O
2(g)△H=a kJ?mol
-1为进一步研究NH
3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应中,a
>
>
0;△s
<
<
0,(填“>”、“<”或“=”)
(4)在一固定容积为2L的密闭容器内加入2mol NH
3和3mol O
2,发生反应4NH
3(g)+5O
2(g)?4NO(g)+6H
2O(g),2min后达到平衡,生成1.2mol NO.则前2分钟的平均反应速率v(NH
3)为
0.3mol/(L?min),
0.3mol/(L?min),
,平衡时O
2的转化率为
50%
50%
,该反应平衡常数的表达式K=
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
,
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
,
.
(5)某温度下,体积均为0.25L的两个恒容密闭容器中发生下列反应:N
2(g)+3H
2(g)
2NH
3(g)△H=-92.4kJ?mol
-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
容器
编号 |
起始时各物质的物质的量/mol |
反应达平衡时的焓变/kJ?mol-1 |
| N2 |
H2 |
NH3 |
| A |
1 |
3 |
0 |
△H1=-23.1 |
| B |
0.9 |
2.7 |
0.2 |
△H2 |
容器B中反应达到平衡状态时的反应热△H
2=
13.86
13.86
.

 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.