
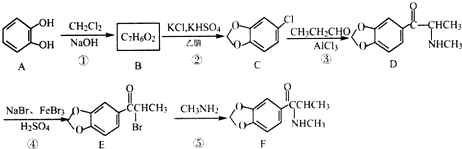
 .
. (填结构简式).
(填结构简式). )的合成路线.
)的合成路线. 分析 (1)根据A的结构可知其分子式为C6H6O2,对比A、C结构与B的分子式、转化条件可知B为 ;
;
(2)根据D的结构简式可知其所含的含氧官能团为羰基、醚键;
(3)对比E和F的结构简式可知,反应⑤为E与氨基甲烷发生取代,E中的溴原子被取代生成F;
(4)B的同分异构体满足:a.属于芳香族化合物,说明含有苯环,b.能与NaOH溶液反应,说明有酚羟基或羧基或酯基,c.结构中除苯环外不含其他环状结构,结合(1)中分析得的B的结构可判断同分异构体的种类,其中核磁共振氢谱显示只有4组峰,说明有4种位置的氢原子,且不能发生银镜反应说明没有醛基,据此可写出B的同分异构体的结构简式;
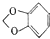
(5)以苯和乙酸为原料制备香料2-羟基苯乙酮,可以用苯与氯气发生取代生成氯苯,氯苯与乙醛反应生成 ,然后在溴化钠、溴化铁、硫酸的作用下生成
,然后在溴化钠、溴化铁、硫酸的作用下生成 ,最后水解得2-羟基苯乙酮(
,最后水解得2-羟基苯乙酮(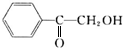 ).
).
解答 解:(1)根据A的结构可知其分子式为C6H6O2,对比A、C结构与B的分子式、转化条件可知B为 ,
,
故答案为:C6H6O2; ;
;
(2)根据D的结构简式可知其所含的含氧官能团为羰基、醚键,
故答案为:羰基、醚键;
(3)对比E和F的结构简式可知,反应⑤为E与氨基甲烷发生取代,E中的溴原子被取代生成F,属于取代反应,
故答案为:取代反应;
(4)B的同分异构体满足:a.属于芳香族化合物,说明含有苯环,b.能与NaOH溶液反应,说明有酚羟基或羧基或酯基,c.结构中除苯环外不含其他环状结构,则符合条件的同分异构体为苯环上连有-OOCH或苯环上连有-CHO、-OH,有邻间对三种,或苯环上连有-COOH,共有5种类,其中核磁共振氢谱显示只有4组峰,说明有4种位置的氢原子,且不能发生银镜反应说明没有醛基的B的同分异构体的结构简式为: ,
,
故答案为:5; ;
;
(5)以苯和乙酸为原料制备香料2-羟基苯乙酮,可以用苯与氯气发生取代生成氯苯,氯苯与乙醛反应生成 ,然后在溴化钠、溴化铁、硫酸的作用下生成
,然后在溴化钠、溴化铁、硫酸的作用下生成 ,最后水解得2-羟基苯乙酮(
,最后水解得2-羟基苯乙酮( ),合成路线流程图为:
),合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物推断与性质,侧重考查学生分析推理能力、信息获取与迁移运用能力,是对有机化学基础的综合考查,难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl HCl H2O NaOH | B. | Cl2Na2S HCl CO2 | ||
| C. | HBr CCl4H2O CO2 | D. | Na2O2H2O2H2O O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
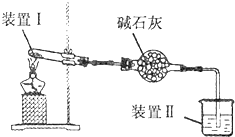 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )| 选项 | 装置I中试剂 | 装置Ⅱ中试剂 | 装置Ⅱ中现象 |
| A | 浸透了石蜡油的石棉和碎瓷片 | 酸性高锰酸钾溶液 | 紫色溶液褪色 |
| B | 铁粉和用水浸泡的棉团 | 肥皂水 | 肥皂水冒泡 |
| C | 碳酸氢钠 | 澄清石灰水 | 有沉淀生成 |
| D | 硫酸铵 | 酚酞溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水、稀豆浆、蔗糖水都能产生丁达尔效应 | |
| B. | 14C可用于文物的鉴定,14C与12C互为同素异形体 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | 黑火药含有硫磺、硝酸钾和木炭,其中硝酸钾是电解质,硫磺和木炭是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
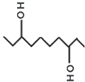
| A. | 该有机物的分子式为C10H20O2 | |
| B. | 该有机物与乙二醇、甘油互为同系物 | |
| C. | 1mol该有机物一定条件下与Na完全反应最多可生成22.4L氢气 | |
| D. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年诺贝尔化学奖颁给了研究细胞修复自身DNA机制的三位科学家.DNA属于有机高分子,化学家鲍林(L.Pauling)提出的氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 | |
| B. | 生物炼铜是指铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性铜盐,使铜的冶炼变得简单 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等的发展促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高的水平层次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com