
【题目】二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________。
(2)已知:Se+2H2SO4(浓)![]() 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O![]() Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3![]() Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3![]() Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________。
【答案】Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑或Se+2HNO3(浓)= SeO2+NO↑+NO2↑+H2O H2SO4(浓)> SeO2> SO2 92.5%或0.925
【解析】
(1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件,生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1可得方程式;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的;
(3)根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=cV计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=nM计算SeO2的质量,进而计算样品中SeO2的质量分数。
(1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为![]() =1,故反应方程式为Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑或Se+2HNO3(浓)= SeO2+NO↑+NO2↑+H2O,
=1,故反应方程式为Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑或Se+2HNO3(浓)= SeO2+NO↑+NO2↑+H2O,
故答案为Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑或Se+2HNO3(浓)= SeO2+NO↑+NO2↑+H2O;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2;
故答案为H2SO4(浓)>SeO2>SO2;
(3)根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000mol/L×0.025L=0.005mol,根据关系式计算样品中n(SeO2)=0.005mol×![]() =0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数=
=0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数=![]() =92.5%;
=92.5%;
故答案为92.5%或0.925。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成___而使Cu2O产率降低。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=___。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
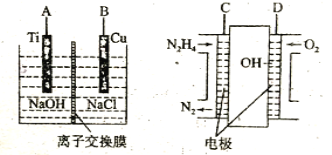
①上述装置中B电极应连___电极(填“C”或“D”)。
②该离子交换膜为___离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为___。
③原电池中负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2组成的混合气体2.4g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. 1.2g B. 2.4 g C. 3.6![]() g D. 无法计算
g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中产生无色气体的化学式:_______。
(2)还原过程中发生的主要反应的离子方程式:______。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃ 干燥2h,冷却密封包装。70℃, 真空干燥、密封包装的原因是:______。
(4)滤液中主要成分是(NH4)2SO4,工业上用(NH4)2SO4与Al2(SO4)3制取铵明矾,铵明矾在食品,制革等方面有重要用途,写出铵明矾的化学式________。
(5)随着pH值减小[Cu2(OH)4-nCln]中Cu%_______。(填字母)
A.增大 B.不变 C.不能确定 D.减小
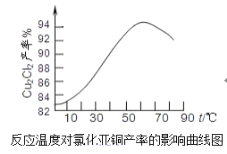
(6)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65 时,CuCl产率会下降,从生成物的角度分析,其原因可能是______。
(7)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭在高温下制取氮化铝。 请回答下列问题:
(1)请写出制取氮化铝的化学方程式________。
制得的AlN样品仅含有Al2O3杂质,已知:AlN+NaOH+H2O=NaAlO2+NH3↑为测定AlN含量,设计如下三种实验方案。(测定过程均忽略NH3在强碱溶液中的溶解)
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
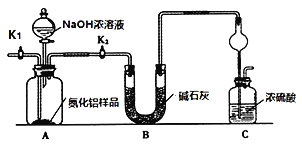
实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
(2)图中C装置中球形干燥管的作用是________。
(3)通入氮气的目的是_______。
(4)图中装置会导致测定结果_______(填“偏高”“偏低”或“无影响”)。
(方案2)用如图装置测定mg样品中AlN的纯度(部分夹持装置已略去)。
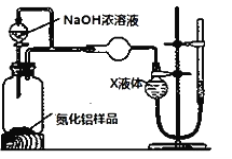
(5)为测定生成气体的体积,量气装置中的X液体可以是___(填字母)
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(6)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则AlN的质量分数是______。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会_____(填“偏高”“偏低”或“无影响”)。
(方案3)按以下步骤测定样品中A1N的纯度:(过滤时使用无灰滤纸过滤)
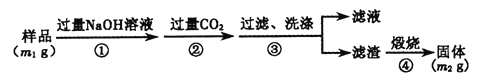
(7)步骤②生成沉淀的离子方程式为_______。
(8)样品中A1N的质量分数为_______(用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确的是( )
A.将25gCuSO4·5H2O硫酸铜晶体溶解在975g水中,所得溶液溶质的质量分数为2.5%
B.0.23gNa与9.77gH2O完全反应,所得溶液溶质的质量分数为2.3%
C.7.8gNa2O2与92.2gH2O完全反应,所得溶液溶质的质量分数为8.0%
D.32.2gNa2SO4·10H2O溶于水配成500 mL溶液中,离子的物质的量浓度为0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.16gO2和O3的混合气体中含有的分子数为0.5NA
B.0.3molAgNO3受热完全分解(2AgNO3=2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C.0.5NA个氯气分子所占体积约是11.2L
D.2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com