
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
科目:高中化学 来源: 题型:
【题目】利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质). 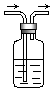
(1)CO2( SO2) , 化学方程式 .
(2)SO2 ( HCl ) , 化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜矿石含有CuO和难溶于水的Cu2(OH) 2CO3 , 还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: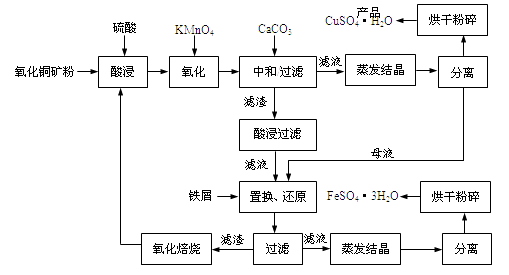
(1)氧化铜矿石粉碎的目的是,KMnO4的作用是将Fe2+氧化成Fe3+。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是,使Fe3+ 水解成沉淀而除去。
(4)流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。
(5)加入铁屑的作用是使母液中Fe3+转化为Fe2+、。
(6)下表为硫酸铜晶体“烘干粉碎”的试验结果。
表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为(指出条件的温度和时间)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。 
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为。B→C的反应条件为 , C→Al的制备方法称为。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)。 a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为。
(4)Ⅱ.含铬元素溶液的分离和利用 用惰性电极电解时, ![]() 能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式)。
能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I),实验过程包括准备标准溶液和滴定待测溶液。 Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L1 AgNO3溶液(过量),使I完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L1NH4SCN溶液滴定过量的Ag+ , 使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是。
(3)滴定应在pH<0.5的条件下进行,其原因是。
(4)b和c两步操作是否可以颠倒 , 说明理由。
(5)所消耗的NH4SCN标准溶液平均体积为mL,测得c(I-)=mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”) ①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素随着原子序数的增大,下列递变规律正确的是
A. 单质熔、沸点逐渐降低B. 单质的氧化性逐渐增强
C. 原子半径逐渐增大D. 气态氢化物稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣13mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣13mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣13mol/L的溶液中:K+、Na+、[Al(OH)4]﹣、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com