
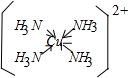
 ;
;
| 1 |
| 2 |
| 1 |
| 2 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-) |
| B、pH=4的醋酸中:c(H+)=1.0×10-4mol?L-1 |
| C、0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% |
查看答案和解析>>
科目:高中化学 来源: 题型:
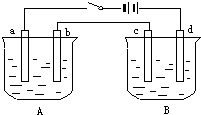 用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | KCl |
| 3 | CuSO4 | NaOH |
| 4 | Na2SO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
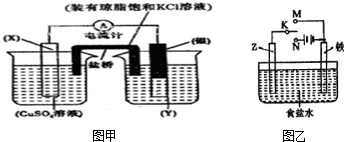
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH═2CH3COO-+H2O+CO2↑ | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 氢氧化钠溶液中通入过量CO2 | OH-+CO2═HCO3- | 错误,通入过量CO2应生 成CO32- |
| C | 硫酸亚铁溶液中加过氧化氢溶液 | Fe2++2H2O2+4H+═Fe3++4H2O | 正确 |
| D | 过量氢氧化钙溶液与碳酸氢镁溶液反应: | 2Ca2++4OH-+Mg2++2HCO3-═Mg(OH)2↓+2CaCO3↓+2H2O | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com