
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
分析 (1)利用高锰酸钾的颜色来判断;
(2)实验I和II研究浓度对反应速率的影响,温度相同,浓度不同;实验I和III研究温度对反应速率的影响,浓度相同中,温度不同;
(3)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式;
(4)实验I和实验IV对比,其他条件相同,实验IV加入MnSO4溶液后反应速率加快,应是催化剂对反应速率的影响;
(5)实验结束后读数前需要移动量气管,使两个量气管的液面相平,使两个量气管的压强相等.
解答 解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾本身作为指示剂,浓度不变,都是2mL,V1=2mL,V3=2mL;实验I和II研究浓度对反应速率的影响,用水来控制溶液的总体积相同,所以草酸体积V2=1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,V4=2mL,V5=0mL,
故答案为:1;2;0;
(3)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,根据转移电子守恒知,KMnO4的计量数是2、H2C2O4的计量数是5,再根据原子守恒得方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O,
故答案为:2;5;3;1;2;10;8;
(4)从实验数据分析,实验I和实验IV对比,其他条件相同,实验IV加入MnSO4后反应速率加快,所以MnSO4溶液在反应中为催化剂,MnSO4是反应产物,开始浓度小,影响不大,随着反应进行,浓度增大,催化效果明显,
故答案为:MnSO4是反应产物,开始浓度小,影响不大,随着反应进行,浓度增大,催化效果明显;
(5)实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是使两个量气管的压强相等,避免产生压强差,影响测定结果,
故答案为:移动量气管,使两个量气管的液面相平.
点评 本题考查影响化学反应速率的因素、氧化还原反应的配平,需要认真分析题中信息,得出合理结论,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 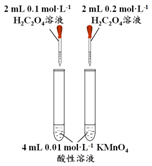 | 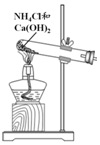 | 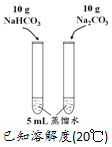 NaHCO3:9.6 g Na2CO3:21.8 g | 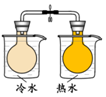 将NO2球浸泡在冷水和热水中 |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是2种核素,他们互称同位素 | |
| B. | 近期化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与C60互称同素异形体 | |
| C. |  与 与 互为同分异构体 互为同分异构体 | |
| D. | 硝基苯可看成是由  和-NO2两种基团组成 和-NO2两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com