
(6分)【Ⅰ】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g) 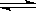 2C(g)+2D(g),
2C(g)+2D(g),
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为 ;
(2)反应前A的物质的量浓度是 ;
【Ⅱ】某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
科目:高中化学 来源: 题型:
| 22.4m |
| 233V |
| 22.4m |
| 233V |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(A).【物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | ||||||||||||||||
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
| 元 素 | D | E | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 。
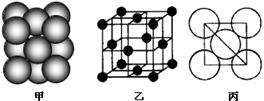 (4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为 。
(B).【实验化学】
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图,。

请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 ,所需要的主要玻璃仪器有 。
(2)在②中用pH试纸测溶液的pH的操作方法是 。
(3)写出④中发生反应的化学方程
式: 。
(4)将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是 、
(任答两条)。
(5)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和 溶液的反应来进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分) 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: 。
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三元月双周练习化学试卷 题型:填空题
(14分) 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。

① 则A-B发生反应的化学方程式为: 。
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南京市四校高三12月月考化学试卷 题型:填空题
(14分) 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 ▲ 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: ▲ 。
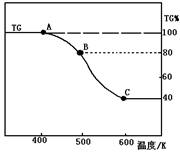
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: ▲ 、 ▲ ;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃.
的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸
亚铁锂的化学方程式为: ▲ 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,
写出相应的电极反应式:
正极 ▲ 、负极 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com