
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 非金属元素之间不可能形成离子化合物 | |
| C. | 气体分子间一定存在分子间作用力,但分子内不一定含共价键 | |
| D. | 两种不同的非金属元素形成的化合物只存在极性共价键 |
分析 A、共价化合物是只含有共价键的化合物;
B、氯化铵是非金属元素之间形成离子化合物;
C、稀有气体中不含共价键;
D、两种不同的非金属元素形成的化合物中可能存在极性键和非极性键;
解答 解:A、共价化合物是只含有共价键的化合物,所以含有共价键的化合物不一定是共价化合物,如NaOH,故A错误;
B、氯化铵是非金属元素之间形成离子化合物,故B错误;
C、稀有气体中不含共价键,但气体分子间存在分子间作用力,故C正确;
D、两种不同的非金属元素形成的化合物中可能存在极性键和非极性键,如多C原子的烃等,故D错误;
故选C.
点评 本题考查化学键和化合物的关系,为高频考点,明确物质构成微粒是解本题关键,易错选项是C,注意采用举例法分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
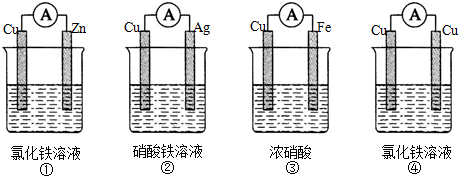
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
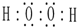 ;肼的结构式
;肼的结构式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
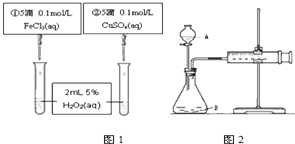
| A. | 图1实验可通过观察产生气泡快慢来比较反应速率的大小 | |
| B. | 若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| C. | 用图2装置可测定反应产生的气体体积 | |
| D. | 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径 C>D>B>A | B. | 原子序数 d>c>b>a | ||
| C. | 单质的活泼性 A>B,D>C | D. | 原子半径 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
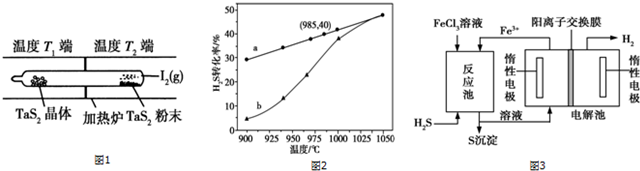
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com