

| A. | 元素第一电离能大小:J>R>Q | |
| B. | 含T元素的两种盐的溶液,一定不能相互反应 | |
| C. | Z的含氧酸一定为强酸 | |
| D. | Q、R、J三元素中J的电负性最大 |
分析 由元素Q、R、J、T、Z在周期表中的位置可知,Q为C,R为N,J为O,T为Al,Z为Cl,然后结合元素周期律来解答.
解答 解:由元素Q、R、J、T、Z在周期表中的位置可知,Q为C,R为N,J为O,T为Al,Z为Cl,
A.非金属性越强,第一电离能越大,但N原子的2p为半满稳定结构,则元素第一电离能大小:R>J>Q,故A错误;
B.含T元素的两种盐的溶液,氯化铝和偏铝酸钠可发生相互促进水解反应,故B错误;
C.Z的含氧酸HClO为弱酸,高氯酸为强酸,故C错误;
D.、R、J三元素中J的非金属性最强,则J的电负性最大,故D正确;
故选D.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,注意规律性知识的应用,电离能与电负性为解答的难点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
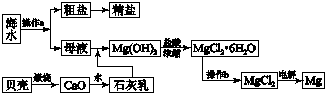
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 | / |
| 步骤2:取适量步骤1滤液于试管中,滴加稀硫酸 | 生成白色沉淀,说明该试剂中含有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,… | …,说明该试剂中含有BaCO3 |
| 步骤4:… | … |
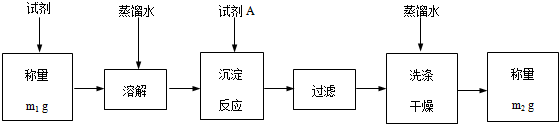
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
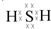 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
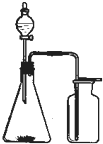 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3 | A. | ②③ | B. | ①⑥⑦ | C. | ②⑤⑧ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
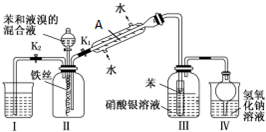

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>H2O>NH3 | B. | 原子半径:F>O>N | ||
| C. | 沸点:乙烷>戊烷>丁烷 | D. | 酸性:H2SO4>H3PO4>HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com