
室温下,将1.000mol•L﹣1盐酸滴入20.00mL 1.000mol•L﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )

|
| A. | a点由水电离出的c(H+)=1.0×10﹣14mol•L﹣1 |
|
| B. | b点:c(NH4+)+c(NH3•H2O)=c(Cl﹣) |
|
| C. | c点:c(Cl﹣)=c(NH4+) |
|
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
考点:
酸碱混合时的定性判断及有关ph的计算.
专题:
压轴题.
分析:
根据酸碱滴定过程的图中a、b、c点的pH值来分析溶液中离子的浓度或溶液中的溶质,并利用原子守恒和电荷守恒来分析解答.
解答:
解:A、因a点7<pH<14,因此水电离出的c(H+)>1.0×10﹣14mol•L﹣1,故A错误;
B、b点时pH>7,则盐酸和氨水反应,氨水过量,则c(NH4+)+c(NH3•H2O)>c(Cl﹣),故B错误;
C、因c点pH=7溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒可知c(Cl﹣)=c(NH4+),故C正确;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选:C.
点评:
本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒来解答此类习题.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)⇌Z(g)+W(s);△H>0下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.平衡后加入X,上述反应的△H增大
C.升高温度,平衡逆向移动
D.当容器中气体压强不变时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
A. 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色
B. 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C. 金属钠放入硫酸铜溶液中可以置换出金属铜
D. 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是( )
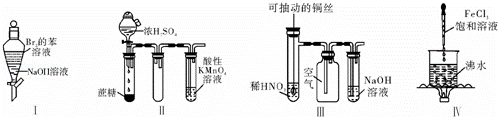
|
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 |
|
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,但颜色不变 |
|
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
|
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学进行试验探究时,欲配制1.0mol•L﹣1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |
|
| 步骤2:取适量滤液于试管中,滴加稀硫酸. |
|
| 步骤3:取适量步骤1中的沉淀于是试管中, |
|
| 步骤4: |
|
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250ml 约0.1mol•L﹣1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L﹣1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下, (填“能”或“不能”) 配制1.0mol•L﹣1Ba(OH)2溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
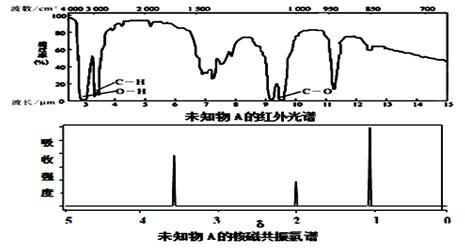
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
24、(9分)A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
 (1)当n=2时,AB2属于________分子(填“极性”或“非极性”),分子中有________个σ键,________个π键。
(1)当n=2时,AB2属于________分子(填“极性”或“非极性”),分子中有________个σ键,________个π键。
(2)当n=3时,A与B形成的晶体属于________晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是________________________(用元素符号表示)。
(4)已知某红紫色络合物的组成为[Co(NH3)5(H2O)]Cl3。该络合物中的中心离子钴离子在基态时核外电子排布式为________,作为配位体之一的NH3分子的空间构型为____________________。其中Co3+与NH3之间的作用力为 。
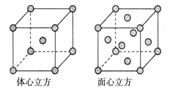
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
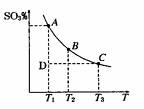 (1)硫酸生产过程中2SO2(g)+O2(g)
(1)硫酸生产过程中2SO2(g)+O2(g)  2SO3(g),平衡混合体系中SO3
2SO3(g),平衡混合体系中SO3
的百分含量和温度的关系如右图所示,根据右图回答下列问题:
①2SO2(g)+O2(g)  2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中
发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
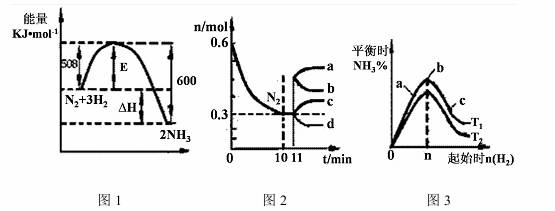
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com