
已知25℃时某溶液中含有大量Na+、H+、Fe3+、HC03﹣、OH﹣、I﹣中的几种,并且水 电离出的c(H+)=1×lO﹣13 mol/L.当向该溶液中缓慢通入一定量的Cl2后,溶液由无色 变为黄色.下列有关分析正确的是( )
|
| A. | 溶液的pH=1或13 | B. | 溶液中一定没有Fe3+,Na+ |
|
| C. | 溶液中阴离子有I﹣,不能确定HCO3﹣ | D. | 当Cl2过量,所得溶液只含有两种盐 |
| 常见离子的检验方法. | |
| 专题: | 离子反应专题. |
| 分析: | 水电离出的c(H+)=1×lO﹣13 mol/L,溶液中氢离子或氢氧根离子浓度为0.1mol/L,该溶液为强酸性或碱性溶液,一定不会存在碳酸氢根离子;当向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色,说明溶液中一定存在碘离子,能够与碘离子反应的铁离子一定不会存在,据此完成本题. |
| 解答: | 解:由水电离出的c(H+)=1×lO﹣13 mol/L,该溶液中大量存在氢离子或者氢氧根离子,所以溶液中一定不会存在碳酸氢根离子;通入氯气后溶液由无色 变为黄色,说明溶液中一定不会存在有色的铁离子,一定存在碘离子, A、根据分析可知,水电离出的c(H+)=1×lO﹣13 mol/L,若为酸性溶液,该溶液pH=1;若为碱性溶液,该溶液的pH为13,故A正确; B、溶液中一定不会存在铁离子,若是碱性溶液,一定存在钠离子,故B错误; C、该溶液中一定存在碘离子,一定不会存在碳酸氢根离子,故C错误; D、氯气过量,反应后只有一种盐,即氯化钠,故D错误; 故选A. |
| 点评: | 本题考查了常见离子的检验方法,题目难度中等,注意明确常见离子的反应现象及检验方法,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力. |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
下列推断正确的是
A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
|
| B. | 凡是放热反应都是自发的,吸热反应都是非自发的 |
|
| C. | 若一个反应的平衡常数越大,则表示该反应速率也越大 |
|
| D. | 升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与日常生活密切相关,下列说法正确的是( )
A. 碘酒只是指碘单质的乙醇溶液
B. 纯水不易导电,但属于电解质
C. 质量分数:医用酒精>生理盐水>食醋
D. 明矾可用于水的消毒、杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
|
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 |
|
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
往含Fe3+、H+、NO3﹣的混合液中加入少量含SO32﹣的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
|
| A. | 2 Fe3++SO32﹣+H2O→2 Fe2++SO42﹣+2 H+ |
|
| B. | 2 H++SO32﹣→SO2↑+H2O |
|
| C. | 2 H++2 NO3﹣+3 SO32﹣→3 SO42﹣+2 NO+H2O |
|
| D. | 2 Fe3++3 SO32﹣+3 H2O→2 Fe(OH)3↓+3 SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,还含有CCl4、I2、I﹣)中回收碘,其实验过程如图1:
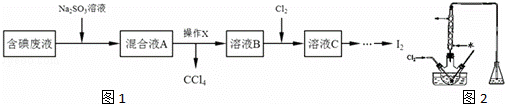
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为 ;该操作的目的是 .
(2)操作X应在 (填写仪器名称图2)中进行,简述得到溶液B的过程:将混合溶液静置后,
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40˚C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 (填溶质的化学式).
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I﹣或IO3﹣.可以使用 (填溶质的化学式,下同)溶液检验可能存在的I﹣或 溶液检验可能存在的IO3﹣.在检验该含碘废水中是否含有I﹣或IO3﹣前必需要进行的操作是 (填序号).
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数,下列有关说法不正确的是( )
A.2.8g乙烯和丙烯的混合物中所含电子总数为1.6NA
B.0.1L 0.1mol/L的甲醛溶液和足量的碱性新制氢氧化铜悬浊液反应提供的电子数为0.02NA
C.0.1摩尔C10H22所含共价键的数目为3.1NA
D.1.7g羟基所含电子数为0.9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol・L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。如何判断滴定终点
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com