

| △ |
| ||
| △ |
| △ |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:

| A、反应速率a>b>c |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时,AB3的物质的量大小为:b>c>a |
| D、达到平衡时A2的转化率大小为:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀 | 完全沉淀 |
| Cu2+ | 4.7 | 6.7 |
| Fe3+ | 1.9 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

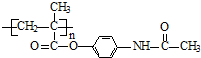 .
.
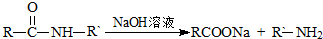
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)| 1 |
| 2 |
| 1 |
| 2 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
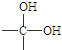 →
→ +H2O
+H2O 、
、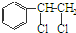 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去.
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
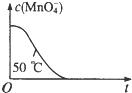
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com