
| A. | 过氧化氢的电子式为  | B. | 1,3-二甲基丁烷 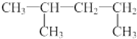 | ||
| C. | Na+的结构示意图为  | D. | 乙烯的结构式为  |
分析 A.氧原子与氧原子之间应共用一对电子;
B.主链选择错误;
C.钠离子核内有11个质子;
D.乙烯分子式为C2H4,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构.
解答 解:A.过氧化氢是共价化合物,两个氧原子之间共用一对电子,过氧化氢的电子式应为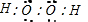 ,故A错误;
,故A错误;
B.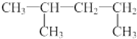 系统命名为:2-甲基戊烷,故B错误;
系统命名为:2-甲基戊烷,故B错误;
C.Na+的结构示意图为: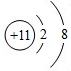 ,故C错误;
,故C错误;
D.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,结构式为: ,故D正确;
,故D正确;
故选:D.
点评 本题考查常用化学用语的书写和判断,熟悉离子结构示意图、电子式、结构式、结构简式的书写是解题关键,题目难度不大.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:解答题
 物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.
物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 88 | B. | 102 | C. | 116 | D. | 196 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L的氧气所含的分子数为NA | |
| B. | 含Cl-数目为0.4NA的CaCl2溶液,CaCl2的物质的量浓度是0.2mol/L | |
| C. | 1.8gNH4+ 中含有的电子数为NA | |
| D. | 标准状况下,含NA个氮原子的N2 和N2O混合气体中,N2 的体积是5.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 欲除去的少量杂质 | 方法或试剂 | 反应的化学方程式 |
| (1)Na2CO3固体中的NaHCO3 | ||
| (2)金属Mg中的Al | ||
| (3)NaOH溶液中的Na2CO3 | ||
| (4)CO2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com