
| A. | A B E H J | B. | B E I J | C. | E H J | D. | F H J |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A.化学平衡时反应物浓度可能等于生成物浓度,也可能不等,与各物质的初始浓度及转化率有关,故错误;
B.化学平衡时容器中N2、H2、NH3浓度之比可能为1:3:2,也可能不等1:3:2,与各物质的初始浓度及转化率有关,故错误;
C.v(N2正)=v(H2正),都体现正反应速率,未体现正与逆的关系,故错误;
D.v(N2正):v(NH3正)=1:2),都体现正反应速率,未体现正与逆的关系,故错误;
E.v(N2正):v(H2逆)=1:3,正逆反应速率相等,达平衡状态,故正确;
F.v(H2正):v(NH3逆)=2:3,速率之比不等于计量数之比,故错误;
G.单位时间内生成1mol的N2时,同时生成3mol的H2,都体现逆反应速率,未体现正与逆的关系,故错误;
H.反应混合体系的压强不随时间的变化而变化,说明气体的物质的量不变,反应达平衡状态,故正确;
I.体积不变,都是气体参与的反应,容器内气体的密度始终不变化,故错误;
J.平均相对分子量不再变化,说明气体的物质的量不变,反应达平衡状态,故正确;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g氖气所含原子数为6.02×1023 | |
| B. | 25℃时,pH=6的水溶液中c(H+)>c(OH-) | |
| C. | 实验室制氢气时加入少量CuSO4可加快反应速率是利用了盐类的水解 | |
| D. | 把16.0 g无水硫酸铜粉末放在足量饱和硫酸铜溶液中会析出25.0 g晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
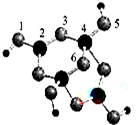 回答以下问题:
回答以下问题:| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
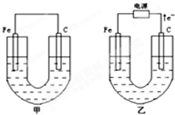 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na的原子半径比K小,故Na的还原性比K强 | |
| B. | 周期表中的每一个横行为一个周期,每一个纵行为一个族 | |
| C. | 相同条件下,不同的可逆反应,其反应的限度不同 | |
| D. | 油脂为人工合成的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com