
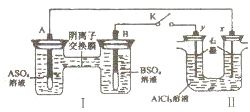
 某同学按如图所示的装置进行试验.A、B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO42-从右向左移动.下列说法错误的是( )
某同学按如图所示的装置进行试验.A、B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO42-从右向左移动.下列说法错误的是( )| A、电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度 |
| B、反应初期,y电极周围出现白色沉淀 |
| C、B电极质量增加 |
| D、x电极产生气泡,且生成1mol气体的同时,有1molA参与反应 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
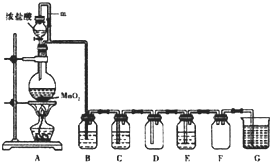 二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图.
二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量使用含磷洗涤剂会带来“白色污染” |
| B、减少并逐渐停止生产和使用氟氯代烷的目的是为了减少酸雨 |
| C、废旧电池中的汞、镉、铅等重金属盐不会对土壤和水源造成污染 |
| D、一个现代化的化工企业,应该朝着无废物排出的“封闭式生产”的方向努力 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,溶液中的BF4-向负极移动 |
| B、放电时,转移1mol电子时正极减少的质量为119.5g |
| C、充电时,阳极附近溶液的酸性减弱 |
| D、充电时,阴极的电极反应式为Pb2++2e-═Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、Fe3+和Fe2+分别属于反应物和生成物 |
| D、若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
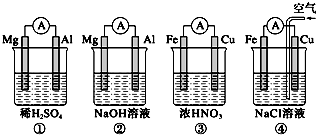
| A、①②中Mg作负极,③④中Fe作负极 |
| B、②中Mg作正极,电极反应式为6H2O+6e-═6OH-+3H2↑ |
| C、③中Cu作负极,电极反应式为Cu-2e-═Cu2+ |
| D、④中Cu作正极,电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com