
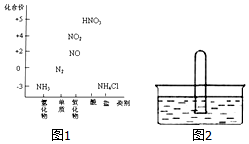
 图1为氮及其化合物的类别与化合价对应的关系图.
图1为氮及其化合物的类别与化合价对应的关系图.分析 (1)①实验室用固体氯化铵和固体氢氧化钙反应制备氨气;
②依据氨气极易溶于水的性质解答;
(2)b.化合价升高的元素体现还原性,氨气催化氧化生成一氧化氮和水,反应中体现氨气的还原性;
(3)①二氧化氮和水反应生成硝酸和一氧化氮;
②求出V mLNO2的物质的量,设消耗的氧气的物质的量为xmol,生成的硝酸的物质的量为ymol,然后根据化学方程式4NO2+O2+2H2O=4HNO3计算;
③NO2和氨气发生归中反应生成氮气.
(4)Fe2O3是碱性氧化物,能和酸反应;而SiO2是酸性氧化物,能和碱反应;
氯气和氢氧化钙反应制取漂白粉.
解答 解:(1)①铵盐和碱反应生成氨气,实验室用固体氯化铵和固体氢氧化钙反应制备氨气,反应的方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气易溶于水,使装置中的压强小于外界的压强,从而引起倒吸,
故答案为:氨水极易溶于水;
(2)b.氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,氨气中-3价N升高为+2价,体现还原性,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(3)①二氧化氮可以和水之间反应,反应物NO2中N元素化合价降低为+2价,升高为+5价,生成硝酸和一氧化氮,反应为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2NHO3+NO;
②标况下V mLNO2的物质的量n=$\frac{V×1{0}^{-3}L}{22.4L/mol}$=$\frac{V}{22400}mol$,设消耗的氧气的物质的量为xmol,生成的硝酸的物质的量为ymol,根据化学方程式4NO2+O2+2H2O=4HNO3可知:4NO2 +O2 +2H2O=4HNO3
4 1 4
$\frac{V}{22400}mol$ xmol ymol
则有:$\frac{4}{\frac{V}{22400}mol}=\frac{1}{xmol}=\frac{4}{ymol}$
解得x=$\frac{V}{22400}×\frac{1}{4}$mol
y=$\frac{V}{22400}$mol
故所消耗的氧气的体积V(O2)=$\frac{V}{22400}×\frac{1}{4}$mol×22.4L/mol=$\frac{V}{4000}$L=$\frac{V}{4}$mL;
由于最终溶液充满整个试管,故所得硝酸溶液的体积为VmL,则硝酸溶液的浓度C=$\frac{\frac{V}{22400}mol}{V×1{0}^{-3}L}$=$\frac{1}{22.4}$mol/L.
故答案为:$\frac{V}{4}$mL;$\frac{1}{22.4}$mol/L;
③NO2和氨气发生归中反应生成氮气和水,故化学方程式为:6NO2+8NH3=7N2+12H2O,故答案为:6NO2+8NH3=7N2+12H2O;
(4)Fe2O3是碱性氧化物,能和酸反应;而SiO2是酸性氧化物,能和碱反应,故能用碱溶液除去Fe2O3中的SiO2,离子方程式为:SiO2+2OH-=SiO32-+H2O;
氯气和氢氧化钙反应制取漂白粉,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
故答案为:SiO2+2OH-=SiO32-+H2O;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查化学方程式的计算,注意把握氨气的性质和制法,解答本题的关键是把握氧化还原反应的特点和化学方程式的有关计算,(3)为易错点,答题时注意是二氧化氮是VmL,而不是二氧化氮和氧气的混合气体.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的结构式:N=N | B. | F-的结构示意图: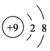 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3 的电子式: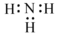 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
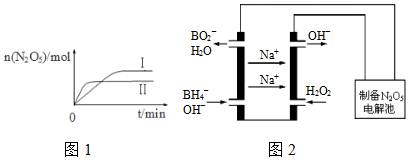
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaClO溶液中,ClO-的数目为0.1NA | |
| B. | 常温常压下,11.2LCH4含有的共用电子对数目为2NA | |
| C. | 16gO2与O3混合气体中,氧原子的数目为1.5NA | |
| D. | 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色 | |
| B. | 自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性 | |
| C. | Cl2、Cl-均有毒 | |
| D. | Cl2、HClO、H2O2都具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com