
| A. | C2H4分子中所有原子共平面 | B. | C2H4既作氧化剂,又作还原剂 | ||
| C. | HCN分子中既含σ键又含π键 | D. | 转移0.2mol电子,生成2.24L H2 |
分析 A、C2H4分子中C原子为sp2杂化,为平面三角形,据此判断;
B、根据C2H4在反应前后化合价的变化判断;
C、根据HCN分子结构为H-C≡N判断;
D、体积未标明标准状态,所以不能计算出2.24L;
解答 解:A、C2H4分子中C原子为sp2杂化,为平面三角形,所以所有原子共平面,故A正确;
B、C2H4在反应中1个C的化合价由-2升高到+2,1个C的化合价由-2降低到-4,所以既作氧化剂,又作还原剂,故B正确;
C、因为HCN分子结构为H-C≡N,所以既含σ键又含π键,故C正确;
D、该反应中只有C2H4在反应中1个C的化合价由-2升高到+2,所以1molC2H4转移4mol电子,则转移0.2mol电子,消耗0.05molC2H4,生成0.05molH2,未标明标准状态,所以不能计算出2.24L,故D错误;
故选D.
点评 本题考查氧化还原反应,难度较大,准确判断物质中元素的化合价是解答本题的关键,HCN中元素的化合价分析是学生解答中的难点.


科目:高中化学 来源: 题型:填空题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
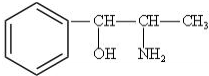 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl.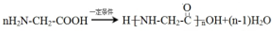 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物炼铜比高温炼铜更清洁、成本更低 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| C. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| D. | 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
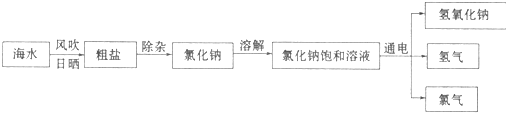
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com