


分析 (1)二氧化硫是酸性氧化物,能和强碱之间发生反应;根据流程图判断可以循环利用的物质;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;
②NaHSO3溶液中HSO3-的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应.
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应;根据流程图中装置Ⅲ可知,Ce4+可以循环利用,
故答案为:SO2+OH-=HSO3-;Ce4+;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(4)①在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,
故答案为:a;
②电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O.
点评 本题考查了电解原理、二氧化硫的污染及治理、化学平衡及其影响等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用基础知识的能力,注意掌握电解原理、化学平衡移动原理及其应用,能够正确书写电极反应式、离子方程式.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
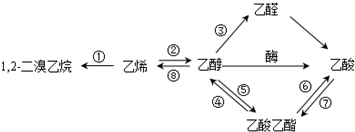
| A. | 反应①是加成反应,反应⑧是消去反应,其它所标明的反应都是取代反应 | |
| B. | 上述物质中能与NaOH溶液反应的只有乙酸 | |
| C. | 1,2一二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 | |
| D. | 等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
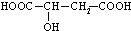 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸能使紫色的石蕊试液变红 | |
| B. | 苹果酸能发生酯化反应 | |
| C. |  与苹果酸是同一种物质 与苹果酸是同一种物质 | |
| D. | 1mol苹果酸在一定条件下可与2molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
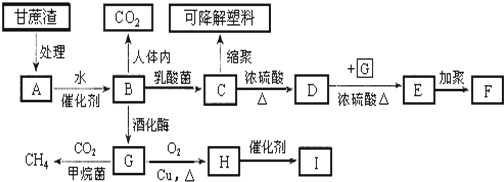
 ;六元环状化合物I
;六元环状化合物I .
.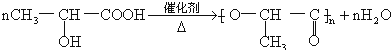 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
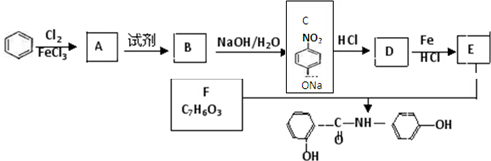
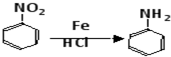
 .
. .
. 、
、 、
、 (任选两种)(写出各种结构).
(任选两种)(写出各种结构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 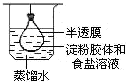 净化精制淀粉胶体 | B. |  测定化学反应速率 | ||
| C. | 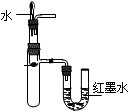 验证Na与水反应是否放热 | D. | 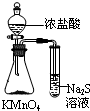 比较KMnO4、Cl2、S的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
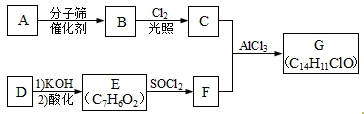
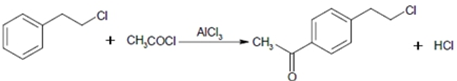
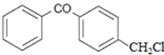 .
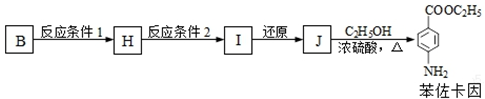
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com