
| A. | 甲烷与氯气反应生成一氯甲烷 | B. | 苯与氢气反应生成环己烷 | ||
| C. | 乙烯与溴反应生成1,2-二溴乙烷 | D. | 乙醇与氧气反应生成乙醛 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
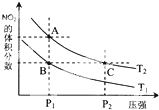 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是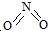 和
和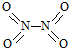 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶 | |
| B. | 量取浓硫酸的体积为24 mL | |
| C. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温 | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44 g CO2的体积是22.4 L | |
| B. | NH3的摩尔质量是17g/mol | |
| C. | 100 mL 1 mol/L NaCl溶液中含有1 mol Cl- | |
| D. | 标准状况下,11.2 L H2O中含有3.01×1023个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
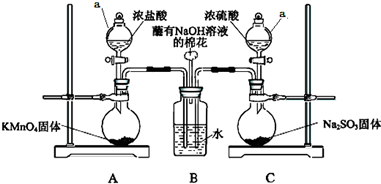 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.
某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较钾、钠:Na、K、H2O | |
| B. | 比较镁、铝:MgCl2溶液、AlCl3溶液、NaOH溶液 | |
| C. | 比较硫、氯:Na2S溶液、NaCl溶液、pH试纸 | |
| D. | 比较溴、碘:溴水、KI淀粉试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com