
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | a为C4H10,b为CO2 | |
| B. | 在熔融电解质中,CO32-向正极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10-26e-+13CO32-=17CO2↑+5H2O |
分析 该原电池为甲烷燃料电池,根据图象中电子流向知,左边电极为负极、右边电极为之间,通入燃料的电极为负极、通入氧化剂的电极为正极,所以a为丁烷、b为O2,负极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O,正极反应式为O2+2CO2+4e-═2CO32-,据此分析解答.
解答 解:A.燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,左边电极是负极、右边电极是正极,所以a是C4H10,b为O2,故A错误;
B.原电池放电时,碳酸根离子向负极移动,故B错误;
C.电解质为熔融碳酸盐,需要高温条件,故C错误;
D.通入丁烷的一极是负极,发生失电子的氧化反应,电极反应为C4H10-26e-+13CO32-=17CO2↑+5H2O,故D正确;
故选D.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L Cl4中含CL原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子书为0.3NA | |
| D. | 常温常压下10g46%酒精溶液中含氧原子总数为 0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a>2b时,发生的离子反应为:2OH-+SO2=SO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+SO2=HSO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2SO2=SO32-+HSO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HSO3-与SO32-的物质的量之比为(a-b):(2b-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子:S-1 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氢氧根的电子式: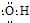 | |
| D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
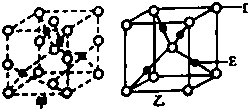 A、B、C、D、E五种元素的元素序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数的2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列问题:
A、B、C、D、E五种元素的元素序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数的2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的体积都是22.4L | |
| B. | 1mol任何物质在标准状况下所占体积都约是22.4L | |
| C. | 1mol氯气、水、碘(I2)在标准状况下所含分子数相同 | |
| D. | 在同温同压下,相同质量的氯气和氢气的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | a、b、c、d四点的Kw不同 | |
| C. | 在Fe(OH)3饱和溶液中加入适量硝酸钾晶体可使a点变到b点 | |
| D. | d点时的Cu(OH)2溶液为不饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com