
【题目】已知25℃时,电离常数Ka(HX)=3.6×10﹣4 , 溶度积常数Ksp(CaX2)=1.46×10﹣10 . 现向1L 0.2mol/LHX溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中正确的是( )
A.25℃时,0.1 mol/LHX溶液中pH=1
B.Ksp(CaX2)随温度和浓度的变化而变化
C.该体系中,c(Cl﹣)=c(Ca2+)
D.该体系中HX与CaCl2反应产生沉淀
【答案】D
【解析】解:A.HX酸为弱酸,不能完全电离,则25℃时,0.1 molL﹣1HX溶液中pH>1,故A错误;
B.Ksp只与温度有关,则Ksp(CaX2)随温度的变化而变化,与浓度无关,故B错误;
C.如生成CaX2沉淀,则c(Cl﹣)>2c(Ca2+),如不生成沉淀,c(Cl﹣)=2c(Ca2+),故C错误;
D.1L 0.2mol/LHX溶液中加入1L 0.2mol/LCaCl2溶液,混合后c(X﹣)= ![]() 、c(Ca2+)=0.1mol/L,则Qc=c2(X﹣)c(Ca2+)=(3.6×10﹣5mol/L)0.1 molL﹣1=3.6×10﹣6>Ksp,说明有沉淀产生,故D正确.
、c(Ca2+)=0.1mol/L,则Qc=c2(X﹣)c(Ca2+)=(3.6×10﹣5mol/L)0.1 molL﹣1=3.6×10﹣6>Ksp,说明有沉淀产生,故D正确.
故选D.


科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断 裂时吸收热量496kJ,氢气中1mol H﹣H键断裂时吸收热量为436kJ,求水蒸气中1mol H﹣O键形成时放出热量( )
A.463kJ
B.557kJ
C.486kJ
D.188kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列气体含有的分子数最多的是( )
A. 36.5g HCl B. 22.4 L O2 C. 4g H2 D. 0.5mol SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是
A.该反应为吸热反应 B.该反应为放热反应
C.断裂H-H键放出能量 D. 生成H-O键吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)蛋白质溶液中含有氯离子,有人用滴加AgNO3溶液再过滤的方法除去氯离子,这样做是错误的。理由是______________________,除去Cl-的正确方法是____________________________。
(2)某有机高分子化合物的结构可表示为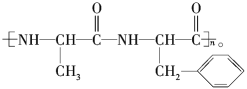 写出其完全水解后所得产物的结构简式:_________________________________。
写出其完全水解后所得产物的结构简式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇 ![]() 制备环己烯:已知
制备环己烯:已知
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入 1ml,浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品. 
①写出环已醇制备环已烯的化学反应方程式
②A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
③试管C置于冰水浴中的目的是 .
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯. ①加入饱和食盐水,振荡、静置、分层,水在层(填上或下).分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在左右.
(3)以下区分环已烯精品和粗品的方法,合理的是 . a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com