
| A. | ②③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑦④⑥ | D. | ④③⑦⑤⑥ |
分析 依据C=$\frac{1000ρω}{M}$计算质量分数为70%、密度为1.42g•cm-3的浓HNO3的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硝酸体积,据此选择量筒规格;用浓溶液配制一定物质的量浓度稀溶液一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,依据各步操作用到的仪器解答.
解答 解:质量分数为70%、密度为1.42g•cm-3的浓HNO3物质的量浓度C=$\frac{1000×1.42×70%}{63}$=15.8mol/L,设配制lmol•L-1的稀硝酸100mL需要浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不得V×15.8mol/L=100mL×1mol/L,解得V=6.3mL,所以应选择10mL量筒;
用浓溶液配制一定物质的量浓度稀溶液一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,一般用量筒量取浓硝酸倒在烧杯中,加水稀释用玻璃棒搅拌,冷却后将浓硝酸引流入100mL容量瓶,然后洗涤烧杯和玻璃棒,再用胶头滴管定容,用到的仪器依次为:10mL量筒、50mL烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以正确的顺序为:②③⑦⑤⑥;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤即可解答,注意量筒、容量瓶规格的选择,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
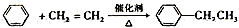

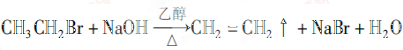 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH2CH3和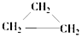 | B. |  和 和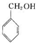 | ||
| C. | 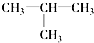 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
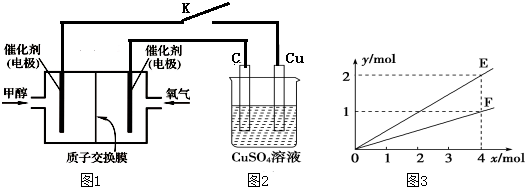
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化吸收大量热,可做制冷剂 | |
| B. | 晶体硅用于制作半导体材料是因其熔点高、硬度大 | |
| C. | 二氧化锰具有强氧化性,故能将双氧水氧化为氧气 | |
| D. | Fe比Cu活泼,所以FeCl3溶液可以腐蚀线路板上的Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com