
 | 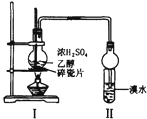 |
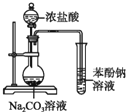
| A.证明酸性:盐酸>碳酸>苯酚 | B.溴水褪色一定产生了乙烯 |
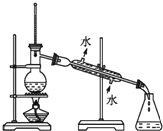 | 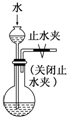 |
| C.分离溴乙烷和水 | D. 检查装置的气密性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl也能和苯酚钠反应生成苯酚而影响碳酸和苯酚钠的反应;
B.浓硫酸被还原生成的二氧化硫能被溴氧化而使溴水褪色;
C.互不相溶的液体采用分液方法分离提纯;
D.能产生压强差的装置能检验装置气密性.
解答 解:A.浓盐酸具有挥发性,生成的二氧化碳中含有HCl,HCl也能和苯酚钠反应生成苯酚而影响碳酸和苯酚钠的反应,故A错误;
B.浓硫酸被还原生成的二氧化硫能被溴氧化而使溴水褪色,所以生成的气体应该先用NaOH溶液除去二氧化硫,然后用溴水检验,故B错误;
C.互不相溶的液体采用分液方法分离提纯,水和溴乙烷不互溶,可以采用分液方法分离提纯,故C错误;
D.关闭止水夹后,如果不漏气,不能形成压强差,所以水不漏下,故能检验装置的气密性,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及气密性检验、物质分离和提纯、物质检验等知识点,明确实验原理、物质性质差异性是解本题关键,注意AB中干扰的物质,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.3% | B. | 12.5% | C. | 87.5% | D. | 85.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
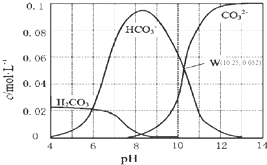 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 0.1 mol•L-1Na2CO3溶液pH=13 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成标准状况下CO2气体224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
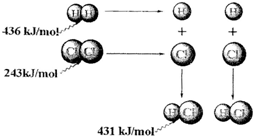
| A. | 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量 | |
| B. | 436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量 | |
| C. | 431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量 | |
| D. | 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同,各元素的质量分数也相同的物质是同种物质 | |
| B. | 通式相同的不同物质一定是同分异构体 | |
| C. | 分子式相同的不同物质一定是同分异构体 | |
| D. | 相对分子质量相同的不同物质一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
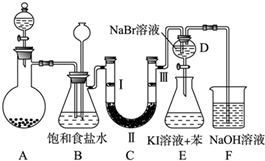
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com