
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
分析 (1)①2O2(g)+N2(g)=N2O4(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3,2×③-2×②-①得,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1,据此进行分析;
(2)H2O(l)=H2O(g)△H=+44kJ/mol,依据盖斯定律计算分析得到;
(3)依据产物判断生成物质无污染;
(4)图象分析可知反应物能量低于生成物,反应为吸热反应,化学反应吸收的热量=反应物键能总和-生成物键能总和.
解答 解:(1)①2O2(g)+N2(g)=N2O4(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3,2×③-2×②-①得,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1,
故答案为:2△H3-2△H2-△H1;
(2)①2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048kJ/mol;
②H2O(l)=H2O(g)△H=+44kJ/mol;
依据盖斯定律①-②×4得到2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1224kJ/mol,
而16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol,与液态双氧水反应生成液态水时放出的热量=0.5mol×1224kJ/mol=612kJ,
故答案为:612;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染,
故答案为:产物不会造成环境污染;
(4)反应过程中能量变化分析可知,反应物能量低于生成物,反应为吸热反应,CH4(g)+2H2O(g)?CO2(g)+4H2(g),破坏1mol化学键需要吸收的热量结合化学方程式计算,反应吸收的热量=4×414KJ/mol+4×464KJ/mol-2×803KJ/mol-4×436KJ/mol=162KJ/mol,
故答案为:+162.
点评 本题考查热化学方程式的书写,盖斯定律的计算判断,反应热的计算应用,注意盖斯定律的应用,题目难度中等


科目:高中化学 来源: 题型:多选题
| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物称为醇 | B. | 能发生银镜反应的有机物都是醛 | ||
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
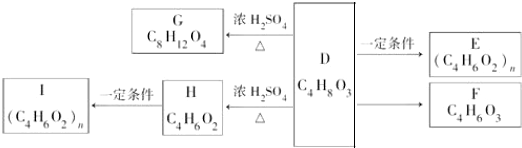
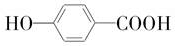 .
.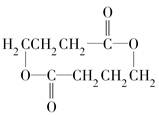 +2H2O.
+2H2O.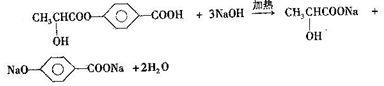 .
.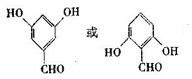 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
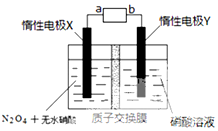 汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.
汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的汽化热为40.69 kJ•mol-1,则H2O(g)?H2O(l)△H=40.69 kJ•mol-1 | |||||||||||
| B. | 已知:
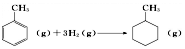 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| C. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||||
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL 2mol/L HCl | B. | 300mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.
TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com