
ЁОЬтФПЁПДгТСЭСПѓЃЈжївЊГЩЗжЪЧAl2O3ЃЌКЌSiO2ЁЂFe2O3ЁЂMgOЕШдгжЪЃЉжаЬсШЁбѕЛЏТСЕФСНжжЙЄвеСїГЬШчЯТЃК
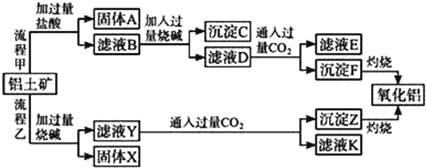
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЙЬЬхAЕФжївЊГЩЗжЪЧ______________ЃЈаДУћГЦЃЉЃЎ
ЃЈ2ЃЉТСЭСПѓгыЙ§СПЩеМюЗДгІЕФРызгЗНГЬЪНЮЊ______ЁЂ______ЃЎ
ЃЈ3ЃЉЕчНтШлШкбѕЛЏТСПЩжЦЕУСНжжЕЅжЪЃЌаДГіИУЗДгІЛЏбЇЗНГЬЪН______________ЃЎ
ЃЈ4ЃЉжИГіСїГЬввЕФвЛИіШБЕуЪЧ____________ЃЎ
ЃЈ5ЃЉбѕЛЏТСгыНЙЬПЕФЛьКЯЮядкЕЊЦјжаИпЮТМгШШЗДгІЃЌжЦЕУаТаЭЗЧН№ЪєВФСЯAlNгывЛжжжабЇГЃМћЦјЬхXЃЎвбжЊУПзЊвЦ6.02ЁС1023ИіЕчзгЃЌга0.5molЛЏКЯЮяXЩњГЩЃЌДЫЗДгІЕФЛЏбЇЗНГЬЪН________________ЃЎ
ЁОД№АИЁП ЖўбѕЛЏЙш Al2O3+2OH_=2AlO2_+ H2O SiO2+2OH_ =SiO32Љ+H2O 2Al2O3==4Al+ 3O2Ёќ бѕЛЏТСжаКЌгаЖўбѕЛЏЙшдгжЪ Al2O3+N2+3C![]() 2AlN+3COЃЎ
2AlN+3COЃЎ
ЁОНтЮіЁПСїГЬМзЃКТСЭСПѓжаМгШыЙ§СПЕФЯЁбЮЫсЃЌSiO2гыбЮЫсВЛЗДгІЃЌAl2O3ЁЂFe2O3ЁЂMgOОљПЩгыбЮЫсЗДгІЩњГЩЯргІЕФТШЛЏЮяЃЌЗДгІЗНГЬЪНЮЊAl2O3ЃЋ6HЃЋ===2Al3ЃЋЃЋ3H2OЃЛFe2O3ЃЋ6HЃЋ===2Fe3ЃЋЃЋ3H2OЃЛMgOЃЋ2HЃЋ===Mg2ЃЋЃЋH2OЃЛЗДгІвКжаМгШыЙ§СПЩеМюЃЌAl3ЃЋБфЮЊAlO2ЃЃЌMg2ЃЋЁЂFe3ЃЋБфЮЊMgЃЈOHЃЉ2КЭFeЃЈOHЃЉ3ГСЕэЃЌЙ§ТЫКѓЃЌТЫвКжаЭЈШызуСПЕФЖўбѕЛЏЬМЦјЬхЃЌЩњГЩСЫAlЃЈOHЃЉ3ГСЕэЃЛЗДгІЗНГЬЪНЮЊAlO2ЃЃЋCO2ЃЋ2H2OЃНAlЃЈOHЃЉ3Ё§ЃЋHCO3ЃЁЃСїГЬввЃКТСЭСПѓжаМгШыЙ§СПЕФЧтбѕЛЏФЦШмвКЃЌFe2O3ЁЂMgOгыЧтбѕЛЏФЦВЛЗДгІЃЌSiO2ЁЂAl2O3ОљгыЧПМюЗДгІЩњГЩЙшЫсФЦКЭЦЋТСЫсФЦЃЌЙ§ТЫЃЌТЫвКжаЭЈШызуСПЕФЖўбѕЛЏЬМЃЌЗДгІЩњГЩСЫAlЃЈOHЃЉ3ГСЕэКЭЙшЫсЁЃ
ЃЈ1ЃЉзлЩЯЫљЪіЃЌЙЬЬхAЕФжївЊГЩЗжЪЧЖўбѕЛЏЙшЃЛе§ШЗД№АИЃК ЖўбѕЛЏЙшЁЃ
ЃЈ2ЃЉТСЭСПѓжаAl2O3ЁЂSiO2ОљгыЧПМюЗДгІЃЌЩњГЩЦЋТСЫсбЮКЭЙшЫсбЮЃЌЗДгІЕФРызгЗНГЬЪНЗжБ№ЮЊЃКAl2O3+2OH-=2 AlO2Ѓ+ H2O ЁЂ SiO2+2OH_ =SiO32Љ+H2OЃЛе§ШЗД№АИЃКAl2O3+2OH_=2AlO2Ѓ+ H2O ЁЂ SiO2+2OH_ =SiO32Љ+H2OЁЃ
ЃЈ3ЃЉЕчНтШлШкбѕЛЏТСПЩжЦЕУН№ЪєТСКЭбѕЦјЃЌЗДгІЛЏбЇЗНГЬЪН2Al2O3==4Al+ 3O2ЁќЃЛе§ШЗД№АИЃК2Al2O3==4Al+ 3O2ЁќЁЃ
ЃЈ4ЃЉSiO2ЁЂAl2O3ОљгыЧПМюЗДгІЩњГЩЙшЫсФЦКЭЦЋТСЫсФЦЃЌЙ§ТЫЃЌТЫвКжаЭЈШызуСПЕФЖўбѕЛЏЬМЃЌЗДгІЩњГЩСЫAlЃЈOHЃЉ3ГСЕэКЭЙшЫсЃЌМгШШКѓЃЌЕУЕНбѕЛЏТСКЭЖўбѕЛЏЙшЃЌМДбѕЛЏТСжаКЌгаЖўбѕЛЏЙшдгжЪ ЃЛе§ШЗД№АИЃКбѕЛЏТСжаКЌгаЖўбѕЛЏЙшдгжЪЁЃ
ЃЈ5ЃЉбѕЛЏТСгыНЙЬПЕФЛьКЯЮядкЕЊЦјжаИпЮТМгШШЗДгІЃЌжЦЕУаТаЭЗЧН№ЪєВФСЯAlNгывЛжжжабЇГЃМћЦјЬхXЃЌИљОндЊЫиЪиКуПЩвджЊЕРXжагІКЌгабѕдЊЫиКЭЬМдЊЫиЃЌвбжЊУПзЊвЦ6.02ЁС1023ИіЕчзгМД1molЕчзгЃЌга0.5molЛЏКЯЮяXЩњГЩЃЌгЩЕчзгзЊвЦЪиКуЃЌПЩЕУдкXжаCЕФЛЏКЯМлЮЊ![]() ,ЫљвдXЪЧCOЃЌЫљвдИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊAl2O3+N2+3C
,ЫљвдXЪЧCOЃЌЫљвдИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊAl2O3+N2+3C![]() 2AlN+3COЃЛе§ШЗД№АИЃКAl2O3+N2+3C
2AlN+3COЃЛе§ШЗД№АИЃКAl2O3+N2+3C![]() 2AlN+3COЁЃ
2AlN+3COЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЩњВњЩњЛюжаЃЌЮвУЧЛсгіЕНИїжжИїбљЕФЛЏбЇЗДгІЁЃЧыАДвЊЧѓЛиД№ЯТСаЮЪЬт:
ЃЈ1ЃЉКИНгИжЬњЪБГЃгУЕФКИвЉЮЊТШЛЏяЇЃЌЦфзїгУЪЧЯћГ§КИНгДІЕФЬњатЁЃЗЂЩњЕФЗДгІЬхЯЕжаЙВгаСљжжЮяжЪЃКNH4ClЁЂN2ЁЂFe2O3ЁЂFeЁЂFeCl3 КЭ XЁЃ
ЂйИљОнЬтвтЃЌПЩХаЖЯГіXЪЧ_____________ЃЈаДЛЏбЇЪНЃЉ
ЂкаДГіВЂХфЦНИУЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂгУЫЋЯпЧХБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЃК______ЁЃ
ЃЈ2ЃЉТСдЊЫиЪЧздШЛНчжаКЌСПзюЖрЕФЕФН№ЪєдЊЫиЃЌгІгУЙуЗКЁЃН№ЪєТСМШФмгыЫсЗДгІгжФмгыЧПМюЗДгІЃЌЧыаДГіТСгыЧПМюЗДгІЕФРызгЗНГЬЪН__________________________________________ ЁЃ
ЃЈ3ЃЉNa2O2ПЩгУзїКєЮќУцОпЕФЙЉбѕМСЃЌ ЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________________________ЁЃ
ЃЈ4ЃЉЁАЫЎВЃСЇЁБГЄЦкБЉТЖдкПеЦјжаЛсБфжЪЃЌетЪЧвђЮЊЁАЫЎВЃСЇЁБгыПеЦјжаЩйСПЖўбѕЛЏЬМНгДЅЃЌЩњГЩСЫШщАзЩЋЕФФ§НКзДГСЕэЕФдЕЙЪЁЃаДГіЗДгІЕФРызгЗНГЬЪН_________________________________ЁЃ
ЃЈ5ЃЉаЁЫеДђПЩзїЮИвЉЃЌЧыаДГіЦфжаКЭЮИЫсЪБЕФРызгЗНГЬЪН______________________ ЁЃ
ЃЈ6ЃЉдкЗДгІ 3BrF3+5H2O = HBrO3+Br2+9HF+O2 жаЃЌБЛбѕЛЏЕФдЊЫиЪЧ____________ЃЌЕБга5 molЫЎЗДгІЪБЃЌгЩH2OЛЙдЕФBrF3ЮЊ______________molЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэИїзщЮяжЪжЎМфЭЈЙ§вЛВНЗДгІВЛПЩвдЪЕЯжШчЯТЭМЫљЪОзЊЛЏЙиЯЕЕФЪЧ

бЁЯю | X | Y | Z | М§ЭЗЩЯЫљБъЪ§зжЕФЗДгІЬѕМў |
A | SiO2 | Na2SiO3 | H2SiO3 | ЂйгыNa2CO3ШлШк |
B | NaCl | NaHCO3 | Na2CO3 | ЂкМгШШ |
C | N2 | NO2 | HNO3 | ЂлМгШШ |
D | C | CO | CO2 | ЂмзЦШШЬПЗл |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПPM 2.5ЁЂSO2ЁЂNOxЕШЃЌЖдМрВтПеЦјжЪСПОпгаживЊвтвхЃЎШЁФГбљБОгУеєСѓЫЎДІРэжЦГЩД§ВтвКЃЌЦфжаЫљКЌРызгЕФЛЏбЇзщЗжМАЦфХЈЖШШчЯТБэЃК
Рызг | K+ | Na+ | NH4+ | H+ | SO42Љ | NO3Љ | ClЉ |
ХЈЖШ/molLЉ1 | 4ЁС10Љ6 | 6ЁС10Љ6 | 2ЁС10Љ5 | a | 2ЁС10Љ5 | 3ЁС10Љ5 | 2ЁС10Љ5 |
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉИљОнБэжаЪ§ОнМЦЫуДЫД§ВтвКжаcЃЈH+ЃЉХЈЖШaЮЊ________mol/LЃЎ
ЃЈ2ЃЉNOxЪЧЦћГЕЮВЦјжаЕФжївЊЮлШОЮяжЎвЛЃЎ
ЂйЦћГЕЗЂЖЏЛњЙЄзїЪБЕФИпЮТЛсв§ЗЂN2КЭO2ЗДгІЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__________ЃЎ
ЂкNOxФмаЮГЩЫсгъЃЌгЩNO2аЮГЩЫсгъЕФжївЊЗДгІЪЧ______________ЃЈаДЛЏбЇЗНГЬЪНЃЉЃЎ
ЃЈ3ЃЉЮЊМѕЩйSO2ЕФХХЗХЃЌГЃВЩШЁЕФДыЪЉгаЃК
ЂйдкШМУКжаМгШыЩњЪЏЛвПЩвдЦ№ЕНЙЬСђЕФзїгУЃЌSO2БЛЮќЪеКѓзЊЛЏГЩвЛжжСђдЊЫиЕФзюИпМлЬЌЕФЛЏКЯЮяЃЌИУЛЏКЯЮяГЃзїЮЊЖЙИЏЩњВњЕФдСЯЃЌЫќдкЖЙИЏЩњВњжаЕФзїгУЪЧ___________ЃЎ
ЂкЮќЪебЬЦјжаЕФSO2ЃЌвдЯТЮяжЪПЩзїЮќЪеМСЕФЪЧ_______ЃЈЬюађКХЃЉЃЛ
aЃЎNaOH bЃЎH2SO4 cЃЎNaHSO3 d. Na2SO3
СђЫсЙЄвЕжаЕФЮВЦјSO2ПЩвдбЛЗРћгУЃЌаДГіSO2зЊЛЏЮЊSO3ЗДгІЕФЛЏбЇЗНГЬЪН_______ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧыЛиД№ЯТСаЮЪЬтЃЎ
ЃЈ1ЃЉЫЎЕФЕчРыЦНКтЧњЯпШчЭМЫљЪОЃЌШєAЕуБэЪО25ЁцЪБЫЎЕФЕчРыДяЦНКтЪБЕФРызгХЈЖШЃЌBЕуБэЪО100ЁцЪБЫЎЕФЕчРыДяЦНКтЪБЕФРызгХЈЖШЃЎ 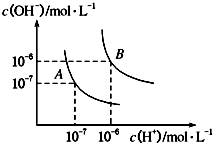
Ђй100ЁцЪБ1molLЉ1ЕФNaOHШмвКжаЃЌгЩЫЎЕчРыГіЕФcЃЈH+ЃЉ=molLЉ1 ЃЌ KWЃЈ25ЁцЃЉKWЃЈ100ЁцЃЉЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЃЎ
Ђк25ЁцЪБЃЌЯђЫЎЕФЕчРыЦНКтЬхЯЕжаМгШыЩйСПNH4ClЙЬЬхЃЌЖдЫЎЕФЕчРыЦНКтЕФгАЯьЪЧЃЈЬюЁАДйНјЁБЁЂЁАвжжЦЁБЛђЁАВЛгАЯьЁБЃЉЃЎ
ЃЈ2ЃЉЕчРыЦНКтГЃЪ§ЪЧКтСПШѕЕчНтжЪЕчРыГЬЖШЧПШѕЕФСПЃЎвбжЊШчБэЪ§ОнЃЎ
ЛЏбЇЪН | ЕчРыЦНКтГЃЪ§ЃЈ25ЁцЃЉ |
HCN | K=4.9ЁС10Љ10 |
CH3COOH | K=1.8ЁС10Љ5 |
H2CO3 | K1=4.3ЁС10Љ7ЁЂK2=5.6ЁС10Љ11 |
Ђй25ЁцЪБЃЌгаЕШХЈЖШЕФaЃЎNaCNШмвК bЃЎCH3COONa ШмвК cЃЎNa2CO3ШмвКЃЌШ§жжШмвКЕФpHгЩДѓЕНаЁЕФЫГађЮЊЃЛЃЈЬюађКХЃЉ
Ђк25ЁцЪБЃЌЕШХЈЖШЕФCH3COOHШмвККЭNaOHШмвКЕШЬхЛ§ЛьКЯЃЌдђcЃЈNa+ЃЉcЃЈCH3COOЉЃЉЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊФбШмадЮяжЪK2SO4MgSO42CaSO4дкЫЎжаДцдкШчЯТЦНКтЃКK2SO4MgSO42CaSO4 ЃЈsЃЉ2Ca2++2K++Mg2++4SO42Љ ЃЎ ВЛЭЌЮТЖШЯТЃЌK+ЕФНўГіХЈЖШгыШмНўЪБМфЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ 
A.ИУЦНКтЕФKsp=c2ЃЈCa2+ЃЉc2ЃЈK+ЃЉcЃЈMg2+ЃЉc4ЃЈSO42ЉЃЉ
B.ЯђИУЬхЯЕжаМгШыБЅКЭK2SO4ШмвКЃЌШмНтЦНКтЯђзѓвЦЖЏ
C.Щ§ИпЮТЖШЃЌШмНўЫйТЪдіДѓЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏ
D.ЯђИУЬхЯЕжаМгШыБЅКЭNaOHШмвКЃЌШмНтЦНКтВЛЗЂЩњвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCКЭSiЖМЪєгкЕкЂєAзхдЊЫиЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ( )
A. CКЭSiЖМЪЧСМКУЕФЕМЕчВФСЯB. CO2КЭSiO2ГЃЮТЯТЖМГЪЦјЬЌ
C. CH4КЭSiH4ЖМЪЧЙВМлЛЏКЯЮяD. H2CO3КЭH2SiO3ЖМЪЧЖўдЊЧПЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБфЛЏЙ§ГЬвЛЖЈашвЊМгШыЛЙдМСЕФЪЧ(ЁЁЁЁ)
A. KClO3ЁњKCl B. KClЁњAgCl
C. HЃЋЁњH2 D. CЁњCO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪжаЛЏбЇМќЕФРраЭЯрЭЌЕФЪЧЃЈ ЃЉ
A.NH3ЁЂMgBr2B.Al2O3ЁЂNaHC.CaCl2ЁЂCO2D.Na2O2ЁЂH2O2
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com