

| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
分析 含铁的废铜为原料加入稀硫酸和稀硝酸的混合溶液,溶解后得到浸出液,在浸出液中主要含有Cu2+、Fe3+、H+、SO42-,加入石灰浆调节溶液PH沉淀铁离子,过滤得到红褐色滤渣为氢氧化铁沉淀,依据石膏和蓝矾的溶解度,控制100°C,滤液中析出石膏,滤液中主要为硫酸铜,通过加热蒸发浓缩,冷却结晶,过滤洗涤,干燥得到硫酸铜晶体;
(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁.
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水.
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯.
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
(5)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用.
解答 解:含铁的废铜为原料加入稀硫酸和稀硝酸的混合溶液,溶解后得到浸出液,在浸出液中主要含有Cu2+、Fe3+、H+、SO42-,加入石灰浆调节溶液PH沉淀铁离子,过滤得到红褐色滤渣为氢氧化铁沉淀,依据石膏和蓝矾的溶解度,控制100°C,滤液中析出石膏,滤液中主要为硫酸铜,通过加热蒸发浓缩,冷却结晶,过滤洗涤,干燥得到硫酸铜晶体;
(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3,故答案为:Fe(OH)3;
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤;
(5)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,故答案为:4NO+3O2+H2O=4HNO3.
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、作图能力等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol镁原子中含有的电子数为2NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 >HCO3-,则下列化学方程式错误的是( )
>HCO3-,则下列化学方程式错误的是( )| A. | 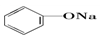 +HCl→ +HCl→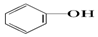 +NaCl +NaCl | B. | 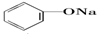 +H2O+CO2→ +H2O+CO2→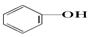 +NaHCO3 +NaHCO3 | ||
| C. | 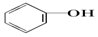 +Na2CO3→ +Na2CO3→ +NaHCO3 +NaHCO3 | D. |  +NaHCO3→ +NaHCO3→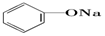 +H2CO3 +H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com