
| ��� | �¶ȣ��棩 | ��ʼ���ʵ��� ��mol�� | ƽ�����ʵ��� ��mol�� | �ﵽƽ������ʱ��s�� | |
| PCl5��g�� | PCl3��g�� | Cl2��g�� | |||
| �� | 320 | 0.40 | 0.10 | 0.10 | t1 |
| �� | 320 | 0.80 | t2 | ||
| �� | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A�� | ƽ�ⳣ��K�������������� | |
| B�� | ��Ӧ����ƽ��ʱ��PCl5��ת���ʣ������������� | |
| C�� | ��Ӧ����ƽ��ʱ���������е�ƽ������Ϊv��PCl5��=$\frac{0.01}{{t}_{1}}$mol/��L•s�� | |
| D�� | ��ʼʱ���������г���PCl5 0.30 mol��PCl30.45 mol��Cl20.10 mol����Ӧ�����淴Ӧ������� |
���� A��I�����¶���ͬ�������ƽ�ⳣ����ȣ����I����¶����ߣ�ƽ��ʱ����PCl3��I�еĴ�˵�������¶�ƽ�������ƶ���ƽ�ⳣ������
B�����º����£����Ч��I��ƽ�������ѹǿ����һ����ƽ�������ƶ���ת���ʼ�С��
C������֮�ȵ��ڻ�ѧ������֮�ȣ���v��PCl5��=v��PCl3��=$\frac{��c��PC{l}_{3}��}{��t}$��
D.410��ƽ��ʱPCl5Ϊ0.4mol-0.15mol=0.25mol������K=$\frac{c��PC{l}_{3}����c��C{l}_{2}��}{c��PC{l}_{5}��}$����ƽ�ⳣ�����ټ���Ũ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У�
��� �⣺A��I�����¶���ͬ�������ƽ�ⳣ����ȣ����I����¶����ߣ�ƽ��ʱ����PCl3��I�еĴ�˵�������¶�ƽ�������ƶ���ƽ�ⳣ������ƽ�ⳣ��K��������������A����
B�����º����£����Ч��I��ƽ�������ѹǿ����һ����ƽ�������ƶ���ת���ʼ�С��PCl5��ת���ʣ�������������B����
C������֮�ȵ��ڻ�ѧ������֮�ȣ���v��PCl5��=v��PCl3��=$\frac{��c��PC{l}_{3}��}{��t}$=$\frac{\frac{0.1mol}{2L}}{{t}_{1}s}$=$\frac{0.05}{{t}_{1}}$mol/��L•s������C����
D.410��ƽ��ʱPCl5Ϊ0.4mol-0.15mol=0.25mol�����¶���ƽ�ⳣ��K=$\frac{c��PC{l}_{3}����c��C{l}_{2}��}{c��PC{l}_{5}��}$=$\frac{\frac{0.15}{2}��\frac{0.15}{2}}{\frac{0.25}{2}}$=0.045��Ũ����Qc=$\frac{\frac{0.45}{2}��\frac{0.1}{2}}{\frac{0.3}{2}}$=0.075��K=0.045����Ӧ���淴Ӧ���У���D��ȷ��
��ѡD��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧ��Ӧ���ʡ�ƽ�ⳣ������Ӧ�õȣ�Ϊ��Ƶ���㣬���ؿ���ѧ���ķ���������������A��Bѡ��ע�����õ�Чƽ������������ƽ�ⳣ��Ӧ�ã��Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/s | 0 | 20 | 40 | 60 | 80 |
| c��N2O4��/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c��NO2��/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
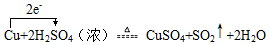 ��ʵ���ã���Ӧ�������˱�״���µ�SO2����44.8L����������������ʵ���Ϊ2mol��
��ʵ���ã���Ӧ�������˱�״���µ�SO2����44.8L����������������ʵ���Ϊ2mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
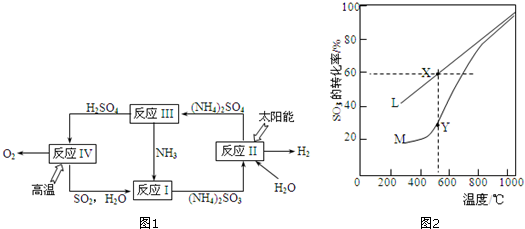
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
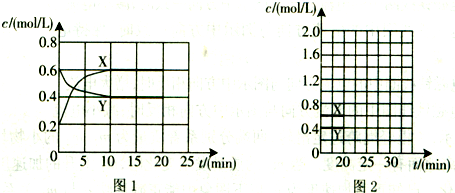
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ijͬѧ��50mL 0.50mol/L��������50mL 0.55mol/L��NaOH��Һ����ͼ1��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų������������к��ȣ�
ijͬѧ��50mL 0.50mol/L��������50mL 0.55mol/L��NaOH��Һ����ͼ1��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų������������к��ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
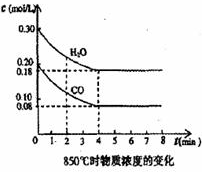 ��һ���Ϊ 10L���ܱ������У�ͨ��һ������CO��H2O����850�淢�����·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0��CO��H2OŨ�ȱ仯��ͼ��
��һ���Ϊ 10L���ܱ������У�ͨ��һ������CO��H2O����850�淢�����·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0��CO��H2OŨ�ȱ仯��ͼ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com