
短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如右表所示。下列说法中正确的是
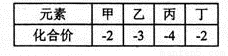
A.元素非金属性:甲<乙
B.含氧酸的酸性:乙<丁
C.氢化物的沸点:甲>丁
D.丙所形成的单质可能互为同位素
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:填空题
以食盐为原料进行生产并综合利用的某些过程如下图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:选择题
将几滴KSCN(SCN一是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。下列说法中不正确的是
A.①中红色褪去的原因是KMnO4将SCN一氧化,使Fe(SCN)3消失
B.②中红色褪色的原因是SO2将Fe3+还原为Fe2+
C.SCN一在适当条件下可失去电子被氧化剂氧化为(SCN)2
D.②中红色褪色的原因是SO2将SCN一还原
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷(解析版) 题型:选择题
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL4mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.16 mol C.0.21 mol D.0.14 mol
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
向等物质的量浓度的MgSO4和NaHSO4的混合溶液中逐滴滴入一定量的Ba(OH)2溶液,下列离子方程式与事实不相符的是
A.H++SO42-+Ba2++OH-→ BaSO4↓+H2O
B.2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O
C.Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O
D.Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶5 B.2∶9 C.1∶7 D.1∶9
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.将纯水加热至较高温度,KW变大、pH变小、呈酸性
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上学期期中考试化学试卷(解析版) 题型:填空题
高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。

(1)Na2FeO4中铁元素化合价是 价,Na2FeO4具有较强的 (填“氧化性”或“还原性”)。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是 (用离子方程式表示)。
(3)工业上可用FeCl3 、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 + 10NaOH + 3NaClO = 2 + 5 + 9 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4 。
①若电解所需的浓NaOH溶液为16 mol/L,则在实验室配制500 mL该浓度的溶液需NaOH的质量为
______g;
② 电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:
阳极的电极反应式为 ;可循环使用的物质是 。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷(解析版) 题型:填空题
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义。
(1)二氧化氮与一定量空气混合通入水中能被水完全吸收,反应的化学方程式为_______________。若该反应有a×NA个电子转移,则参加反应的二氧化氮的物质的量为___________。
(2)下列除去大气污染物的化学方程式不正确的是___________。
A.汽车尾气经催化剂作用:CO+NO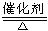 NO2+C
NO2+C
B.石灰乳吸收硫酸厂尾气:SO2+Ca(OH)2=CaSO3+H2O
C.燃烧法除去尾气中硫化氢:2H2S+3O2 2SO2+2H2O
2SO2+2H2O
D.氨气与一氧化氮在一定条件下反应:4NH3+6NO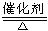 5N2+6H2O
5N2+6H2O
(3)大多数非金属氧化物能被氢氧化钠溶液吸收。例如,NaOH+SO2=NaHSO3,2NaOH+SO2=Na2SO3+H2O,
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,NO不溶于氢氧化钠溶液或水。
①同种反应物,其反应产物与浓度、温度、反应物相对量等因素有关。影响二氧化硫与氢氧化钠反应产物的因素与下列反应相同的是___________。
A.木炭与氧气反应
B.硫与氧气反应
C.钠与氧气
D.铜与硝酸溶液反应
②某NO与NO2混合气体通入氢氧化钠溶液被完全吸收,推测混合气体中气体组成为________。
A. 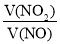 =1 B.
=1 B. 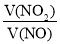 ≤1
≤1
C. 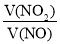 ≥1 D.无法判断
≥1 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com