
| A、乙醛、葡萄糖、蔗糖都能发生银镜反应 |
| B、淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
| C、油脂水解可得到氨基酸和甘油 |
| D、向蛋白质溶液中滴加饱和硫酸钠溶液后,蛋白质会发生变性 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
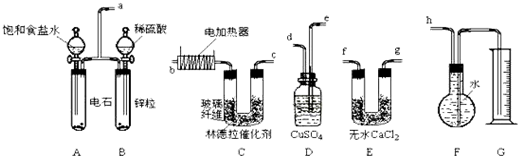
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种纯净物 |
| B、它的链节是-CF2=CF2- |
| C、它是缩聚反应的产物 |
| D、它的单体是CF2=CF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c |
| B、a>b>c |
| C、a>c>b |
| D、c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料、合成纤维和合成橡胶应用非常广泛,并称为“三大合成材料” |
| B、液化石油气、汽油和石蜡的主要成分都是碳氢化合物 |
| C、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D、石油裂解和油脂皂化都是由高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
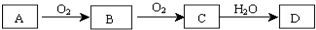
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com