
| A. | 该溶液中:c(OH-)>c(Na+)>c(SO32-)>c(HSO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(SO32-) | |
| C. | 该溶液的溶质为Na2SO3和NaHSO3 | |
| D. | 该溶液pH约为10的原因是NaOH过量 |
分析 某同学用稀NaOH溶液作SO2的尾气吸收液,实验完毕测得吸收液的pH约为10,相同温度下饱和Na2SO3溶液的pH约为9.5,说明二氧化硫被吸收后生成亚硫酸钠,氢氧化钠剩余,溶液中溶质为氢氧化钠和亚硫酸钠,据此分析选项.
解答 解:A.分析可知溶液中溶质为氢氧化钠和亚硫酸钠,溶液PH=10,相同温度下饱和Na2SO3溶液的pH约为9.5,说明氢氧化钠少量剩余,溶液中c(OH-)<c(Na+),故A错误;
B.溶液中存在电荷守恒为:c(Na+)+c(H+)═c(OH-)+2c(SO32-)+c(HSO3-),故B错误;
C.用稀NaOH溶液作SO2的尾气吸收液,实验完毕测得吸收液的pH约为10,相同温度下饱和Na2SO3溶液的pH约为9.5,说明二氧化硫被吸收后生成亚硫酸钠,氢氧化钠剩余,溶液中溶质为氢氧化钠和亚硫酸钠,故C错误;
D.用稀NaOH溶液作SO2的尾气吸收液,实验完毕测得吸收液的pH约为10,相同温度下饱和Na2SO3溶液的pH约为9.5,说明是NaOH过量,故D正确;
故选D.
点评 本题考查了溶液酸碱性的分析判断、物质性质理解应用、电解质溶液中电荷守恒、离子浓度大小比较等,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).
、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).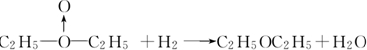 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI | B. | F2、Cl2、Br2、I2 | ||
| C. | H2O、H2S、H2Se、H2Te | D. | CI4、CBr4、CCl4、CF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡晶体与氯化铵混合研磨 | B. | 用铜与浓硝酸制取NO2 | ||
| C. | 烧碱溶液与硫酸氢钠溶液混合 | D. | 镍镉充电电池放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1Na2S溶液中:c(OH-)=c(H2S)+c(HS-) | |
| B. | 0.1mol•L-1 CH3COONH4溶液中:c(NH4+)+c(NH3•H2O)=c(CH3COO-)+c(CH3COOH) | |
| C. | 0.1mol•L-1pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) | |
| D. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物碳元素的质量分数38.71% | B. | 该化合物的实验式为CH3 | ||
| C. | 该化合物分子式为C2H6O2 | D. | 该化合物中不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol Cl2通入一定量水中,HClO、Cl-、ClO-粒子数之和为0.2NA | |
| B. | 12g NaHSO4固体中含阳离子数为0.1NA | |
| C. | 将1molFe(OH)3加入到含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA | |
| D. | 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com