
| 选项 | 实验 | 现象 | 结论 |
| A | 向碳酸钠溶液中滴入酚酞试液,加热 | 溶液红色加深 | 碳酸钠水解吸热 |
| B | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
| C | 向Fe(NO3)2溶液中先滴入KSCN溶液再滴加盐酸 | 加入盐酸后溶液变成血红色 | Fe2+被盐酸氧化为Fe3+ |
| D | 向1mL0.1mol/LMgSO4溶液中滴入10mL等浓度的NaOH溶液,片刻后再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,酚酞遇碱变红色,升高温度,平衡向吸热方向移动;
B.NaAlO2溶液中滴加饱和NaHCO3溶液,AlO2-与HCO3-电离出的氢离子、水反应生成氢氧化铝;
C.酸性条件下,硝酸根离子具有强氧化性,能氧化还原性离子;
D.硫酸镁和NaOH溶液反应时NaOH过量,过量的NaOH和硫酸铜反应生成氢氧化铜沉淀.
解答 解:A.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,酚酞遇碱变红色,升高温度,平衡向吸热方向移动,升高温度,溶液颜色加深,说明溶液碱性增强,则升高温度促进碳酸钠水解,盐类水解是吸热反应,故A正确;
B.NaAlO2溶液中滴加饱和NaHCO3溶液,AlO2-与HCO3-电离出的氢离子、水反应生成氢氧化铝沉淀,HCO3-电离出的氢离子促进AlO2-的水解,AlO2-的水解促进HCO3-电离,故B错误;
C.酸性条件下,硝酸根离子具有强氧化性,能氧化还原性离子亚铁离子生成铁离子,盐酸的弱氧化性不能氧化亚铁离子,故C错误;
D.硫酸镁和NaOH溶液反应时NaOH过量,过量的NaOH和硫酸铜反应生成氢氧化铜沉淀,不是发生沉淀的转化,所以不能据此判断溶度积常数大小,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及盐类水解、氧化还原反应、溶度积常数大小比较等知识点,明确实验原理及物质性质是解本题关键,注意CD中反应实质,易错选项是CD.


科目:高中化学 来源: 题型:解答题
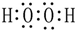 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 可将工业酒精兑水后饮用,因为其中含有甲醇、乙醇,它具有醇香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
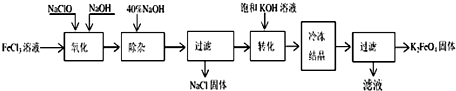
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
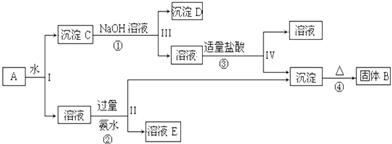
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
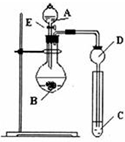 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com