


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
A、硫酸铜溶液与氢氧化钡溶液反应:SO
| ||
B、将大理石投入到足量盐酸中:CO
| ||
| C、将Cl2通入KI溶液中:I-+Cl2═Cl-+I2 | ||
| D、向AlCl3溶液中加入过量的氨水反应:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于0.8mol |
| B、小于0.8mol |
| C、大于0.6mol |
| D、等于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | A≡B | ||
| CO | 键能(kl/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kl/mol) | 441.2 273 | |||
| N2 | 键能(kl/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值(kl/mol) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
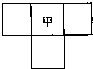 甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.
甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
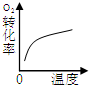
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )| A、1.0L 1.0mol?L-1H2SO4溶液中,H2SO4分子数为6.02×1023 |
| B、标准状况下,1mol SO3中所含的原子数为 6.02×1023 |
| C、32g S8单质中含有的S-S键个数为6.02×1023 |
| D、22.4L SO2中所含的分子数为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com