
����Ŀ��ij�¶��£���10 mL 0.1 mol��L��1 CuCl2��Һ�еμ�0.1 mol��L��1��Na2S��Һ���μӹ����У�lg c(Cu2��)��Na2S��Һ����Ĺ�ϵ��ͼ��ʾ�������й�˵����ȷ����
��֪��Ksp(ZnS)��3��10��25
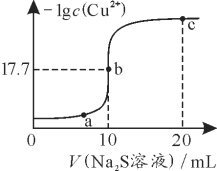
A. Na2S��Һ�У�c(S2��)��c(HS��)��c(H2S)��2c(Na��)
B. a��b��c�����Ӧ����Һ�У�ˮ�ĵ���̶�����Ϊb��
C. ���¶��£�Ksp(CuS)��1��10��35.4
D. ��100 mL Zn2����Cu2�����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L��1�Ļ����Һ����μ���10��3 mol��L��1��Na2S��Һ��Zn2���ȳ���
���𰸡�C
��������
��10mL0.1mol/LCuCl2��Һ�еμ�0.1mol/L��Na2S��Һ��������Ӧ��Cu2++S2-=CuS����Cu2+�������ڻ�S2-�������ھ���ˮ�⣬ˮ��ٽ�ˮ�ĵ��룬���ͼ������ܶȻ���������Һ�е��غ�˼�룬�ݴ��жϷ�����
��10mL0.1mol/LCuCl2��Һ�еμ�0.1mol/L��Na2S��Һ��������Ӧ��Cu2++S2-=CuS����Cu2+�������ڻ�S2-�������ھ���ˮ�⣬ˮ��ٽ�ˮ�ĵ��룬b����Һʱ�μ�Na2S��Һ�������10mL����ʱǡ������CuS������CuS���ڳ����ܽ�ƽ�⣺CuS��s��![]() Cu2+��aq��+S2-��aq������֪��ʱ-lgc��Cu2+��=17.7����ƽ��ʱc��Cu2+��=c��S2-��=10-17.7mol/L��
Cu2+��aq��+S2-��aq������֪��ʱ-lgc��Cu2+��=17.7����ƽ��ʱc��Cu2+��=c��S2-��=10-17.7mol/L��
A��Na2S��Һ�У����������غ㣬2c(S2��)��2c(HS��)��2c(H2S)��c(Na��)����A����
B��Cu2+�������ڻ�S2-�������ھ���ˮ�⣬ˮ��ٽ�ˮ�ĵ��룬b��ʱǡ���γ�CuS��������ʱˮ�ĵ���̶Ȳ�����a��b��c���������ģ���B����
C�����¶��£�ƽ��ʱc��Cu2+��=c��S2-��=10-17.7mol/L����Ksp��CuS��=c��Cu2+��![]() c��S2-��=10-17.7mol/L��10-17.7mol/L=10-35.4mol2/L2����C��ȷ��
c��S2-��=10-17.7mol/L��10-17.7mol/L=10-35.4mol2/L2����C��ȷ��
D����100mLZn2+��Cu2+Ũ�Ⱦ�Ϊ0.1mol��L��1�Ļ����Һ����μ���10��3 mol��L��1��Na2S��Һ������ZnSʱ��Ҫ��S2-Ũ��Ϊc��S2-��=![]() =
=![]() mol/L=3��10-24mol/L��
mol/L=3��10-24mol/L��
����CuSʱ��Ҫ��S2-Ũ��Ϊc��S2-��=![]() =
=![]() mol/L=10-34.4mol/L�������CuS��������S2-Ũ�ȸ�С�����Ȳ���CuS��������D����
mol/L=10-34.4mol/L�������CuS��������S2-Ũ�ȸ�С�����Ȳ���CuS��������D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����(����)
A.24gþ�����������г��ȼ��ʱת�Ƶ���������![]()
B.![]() ������������NaOH��Һ��ת�Ƶĵ�����Ϊ
������������NaOH��Һ��ת�Ƶĵ�����Ϊ![]()
C.��״���£�![]() �к��е�ԭ����ĿΪ
�к��е�ԭ����ĿΪ![]()
D.���³�ѹ�£�![]() ��
��![]() �Ļ�������к��е�ԭ����Ϊ
�Ļ�������к��е�ԭ����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ܱ������з�����ѧ��Ӧ��2A(g) ![]() B(g)��C(g)��������A����ʼŨ��Ϊ1.0 mol��L��1������B��C����ʼŨ��Ϊ0ʱ������A��Ũ�ȡ�ת�����Լ�����B��Ũ���淴Ӧʱ��ı仯�����и�ͼ��ʾ��
B(g)��C(g)��������A����ʼŨ��Ϊ1.0 mol��L��1������B��C����ʼŨ��Ϊ0ʱ������A��Ũ�ȡ�ת�����Լ�����B��Ũ���淴Ӧʱ��ı仯�����и�ͼ��ʾ��

�������й�˵������ȷ����
A. ����I������IIʱ�ķ�Ӧ�¶Ȳ�ͬ��ѹǿ��ͬ
B. ����Iʱ����δʹ�ô���������IIʱ����ʹ���˴���
C. ����IIIʱ��ƽ�������У�����C��Ũ�ȵ���0.6 mol��L��1
D. ����IV������II��Ƚϣ�����IVʱ������С���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ũ���ᡢŨ���ᡢŨ�������ʶ����ȷ����
A.Ũ���ᡢŨ�����������Ӧʱ���ֱ���S��N�õ���
B.������Ũ�����Ϻ�ɫ���ǹ�����ɺ�ɫ���ɵ�̼��������Ũ�������ˮ��
C.Ũ���ᡢŨ������лӷ��ԣ���Ũ�����ѻӷ�
D.�����£�Ũ�����ŨHNO3��Ͷ��FeƬ�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܺ���Cl����SO42-��CO32-��NH4+��Fe3+��Fe2+��Al3+��Na+��ijͬѧΪ��ȷ����ɷ֣���Ʋ����������ʵ�顣�ɴ˿�֪ԭ��Һ��

A. ԭ��Һ��c(Fe3+)��0.1 mol��L��1
B. Ҫȷ��ԭ��Һ���Ƿ���Fe2+����������£�ȡ����ԭ��Һ���Թ��У���KSCN��Һ���ټ���������ˮ����Һ��Ѫ��ɫ������Fe2+
C. SO42-��NH4+��Na+һ�����ڣ�CO32-��Al3+һ��������
D. ��Һ��������4�����Ӵ��ڣ�����Cl��һ�����ڣ���c(Cl��)��0.2 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����λͬѧ�ֱ�����ͼ��ʾ������ʵ��װ�ü���ѧҩƷ(���м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ����)��ȡ�������������̽��,���ش���������:
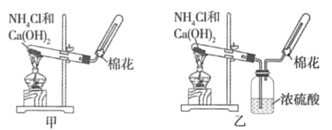
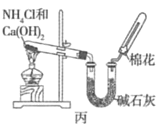
��1����λͬѧ��ȡ�����Ļ�ѧ����ʽΪ__________��
��2����λͬѧ���������ſ������ռ�����,��������ˮ��,��ԭ����__________(�����)��
A.����������ˮ B.������������ˮ
C.�����ܶȱȿ����� D.�����ܶȱȿ���С
��3����λͬѧ������װ����ȡ����ʱ,������һλͬѧû���ռ�������(���ǵ�ʵ���������ȷ),����Ϊû���ռ���������ͬѧ��__________(��ס������ҡ�����),�ռ�������������Ҫԭ����__________________________��
��4�����鰱���Ƿ��ռ����ķ�����__________(�����)��
A.�ŵ��а����ݳ� B.��ʪ��ĺ�ɫʯ����ֽ���Թܿڼ���,������ֽ����
C.���������� D.��ʪ�����ɫʯ����ֽ���Թܿڼ���,������ֽ���
��5����λͬѧ����Ϊ���ǵ�ʵ��װ��Ҳ�����ڼ���̼����粒�����ȡ�����İ���,���ж��ܹ��ﵽʵ��Ŀ�ĵ�ͬѧ��__________(��ס������ҡ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����ݸ���֪ʶ������²ⶨ���ڼ�ȩ������װ��(�гּ�β��������װ������)��

��������������Һ
��1���ر�K2��K3����K1�ͷ�Һ©��������������ʳ��ˮ���뵽Բ����ƿ�У����۲쵽������ƿ��������ɵİ�ɫ����ǡ����ȫ�ܽ�ʱ���ر�K1�ͷ�Һ©����������д��������ƿ������������Һ�Ļ�ѧ����ʽ________________________��
II���ⶨ���ڿ����м�ȩ����
��2��װ����ëϸ�ܵ�������________________________________________________��
��3������ˮԡ����������ƿ����K3������������������˳鵽���Ҷˣ�����1L���ڿ������ر�K3������������_________________________________________�����ƽ�����������ʮ�Ρ�
��4������ȩ��ֱ�������Һ����Ϊ̼���κ������ƿ�й�����Ag 2.16mg��������м�ȩ�ĺ���Ϊ___________mg��L��1���������������ʲ���������Һ��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
(1)��������β���ķ���֮һ�����������ϰ�װ��ת�������������·�Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)����H��0
N2(g)+2CO2(g)����H��0
��һ�������£��������Ϊ1��2��NO��CO�������ں����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����___(����ĸ)��
A����ϵѹǿ���ֲ��� B�����������ɫ���ֲ���
C��N2��CO2������ȱ��ֲ��� D��v��(CO)��2v��(N2)
��20minʱ�����ı䷴Ӧ����������N2Ũ�ȷ�������ͼ��ʾ�ı仯����ı������������______(����ĸ)��
A����������� B�������¶ȡ� C������CO2���� D����С�������

(2)��һ�������£���SO2��NO2ͨ����Ⱥ����ܱ������У�������Ӧ��SO2(g)+NO2(g) ![]() SO3(g) +NO(g)������Ӧ������ʱ��仯��ͼ��ʾ����ͼ�ɵó�����ȷ������__(����ĸ)
SO3(g) +NO(g)������Ӧ������ʱ��仯��ͼ��ʾ����ͼ�ɵó�����ȷ������__(����ĸ)

A����Ӧ��c��ﵽƽ��״̬
B����Ӧ��Ũ�ȣ�b��С��c��
C����Ӧ��������������������������
D����t1=��t2ʱ��SO2��ת���ʣ�a��b��С��b��c��
(3)����һ�����͵Ĵ�������Ҫ�ɷ���Cu-Mn�ĺϽ𣩣�����CO��H2���Ʊ�������(DME)���۲�ͼ�ش����⡣

������n(Mn)/n(Cu)ԼΪ__________ʱ�������ڶ����ѵĺϳɡ�
(4)��ҵ�Ͽ�����CO��H2����ȼ�ϼ״���CO(g)+2H2(g)![]() CH3OH(g)��H=��92.9kJ/mol��300�棬���ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ����й��������£�
CH3OH(g)��H=��92.9kJ/mol��300�棬���ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ����й��������£�
���� | �� | �� | �� | |
��Ӧ��Ͷ���� | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
ƽ�� ʱ�� ���� | CH3OHŨ��/mol��L-1 | c1 | c2 | c3 |
��Ӧ�������仯 | �ų�a kJ | ����c kJ | ||
��ϵѹǿ/Pa | p1 | p2 | p3 | |
��Ӧ��ת���� | ��1 | ��2 | ��3 | |
����˵������ȷ����____________
A��2c1>c3 B��a+b=92.9 C��2p2<p3 D����1+��3<1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������������������ȷ���ǣ�������
A.��״���£�22.4L H2����������������������Ϊ2NA
B.32g O2�����32g O3�����ԭ����֮��Ϊ3��2
C.1L 1molL��1��������������������Ϊ2NA
D.71g�������������۳�ַ�Ӧ��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com