
| 有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
| 相对分子质量 | 32 | 42 | 34 |
| 沸点/℃ | 64.7 | -47.4 | -78.2 |
分析 (1)在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9;
(2)根据共用电子对偏向电负性大的原子进行解答;
(3)①根据价层电子对互斥理论确定键角;②根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;③石墨烯中每个C原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化类型;
(4)①分子间存在着氢键,熔、沸点升高;②单键为σ键,双键中具有1个σ键、1个π键;③甲烷为正四面体,一氟甲烷为四面体结构.
解答 解:(1)在基态Ti2+中,核外电子排布为1s22s22p63s23p63d2,电子占据的最高能层符号为M,该能层具有的原子轨道数为9,
故答案为:M;9;
(2)共用电子对偏向电负性大的原子,CH4中共用电子对偏向C,则电负性C>H;SiH4中共用电子对偏向H,则电负性H>Si,所以C、Si、H的电负性大小关系为:C>H>Si,
故答案为:C>H>Si;
(3)①甲醛中C原子形成3个σ键,为sp2杂化,是平面三角形结构,键角为120°,甲醇分子内碳原子形成4个σ键,无孤电子对,杂化方式为sp3杂化,是四面体结构,O-C-H键角约为109°28′,键角小于120°,所以甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小,
故答案为:小于;
②ClO2-中心氯原子的价层电子对数=2+$\frac{7+1-2×2}{2}$=4,所以杂化方式为sp3杂化;N2与CN-具有相同的电子数目和原子数目的微粒,属于等电子体,
故答案为:sp3;N2;
③石墨烯中每个C原子价层电子对个数是3,根据价层电子对互斥理论知C原子杂化类型为sp2,
故答案为:sp2;
(4)①甲醇分子间存在着氢键,沸点升高,
故答案为:甲醇分子之间可以形成氢键;
②1mol丙烯(CH2=CH-CH3)分子中含有6mol碳氢σ键、1mol碳碳σ键,1mol碳碳双键中含有1molσ键和1molπ键,所以1mol丙烯中含有8molσ键、1molπ键,σ键和π键数目之比为8:1,
故答案为:8:1;
③甲烷为正四面体,四个碳氢键键长相等,一氟甲烷为甲烷的一取代物,1个碳氟键与其它3个碳氢键不同,为四面体结构,
故答案为:四面体型.
点评 本题考查物质结构和性质,涉及核外电子排布、元素电负性、键角大小比较、杂化等知识,熟练掌握基础知识并灵活运用基础知识解答问题是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| B. | NaHCO3溶液和足量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
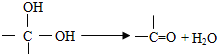 试回答下列问题:
试回答下列问题:
 .它可以发生ab(填字母)
.它可以发生ab(填字母)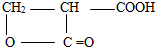 、
、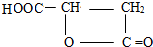 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22P6 | B. | 1s22s22P33s1 | C. | 1s22s22P63s2 | D. | 1s22s22P63s23P6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: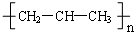 | |
| B. | 某塑料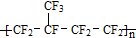 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子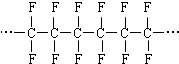 的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料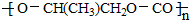 可由 可由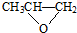 和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com