
70 30 |
208 82 |
277 112 |
1 0 |
| A、上述合成过程中属于化学变化 | ||
| B、Cn元素的相对原子质量为277 | ||
C、
| ||
| D、Cn元素位于元素周期表的第六周期,是副族元素 |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、①和②产物的阴阳离子个数比相等 |
| B、①和②生成等物质的量的产物,转移电子数不同 |
| C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D、0℃、101kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的物质的量增大 |
| D、C的体积分数保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
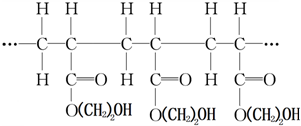
| A、它是缩聚反应的产物 |
| B、其单体是CH2=CH2COOH和HOCH2CH2OH |
| C、其链节是CH3CH2COO(CH2)2OH |
| D、其单体是CH2=CHCOO(CH2)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
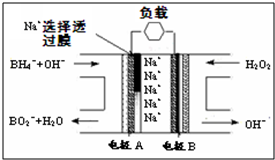
| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区电极反应:BH4-+8OH--8e-═BO2-+6H2O |
| C、放电过程中,Na+从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应:
在容积固定为2L的密闭容器中,充入0.18molHI,480℃时反应:| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

查看答案和解析>>
科目:高中化学 来源: 题型:
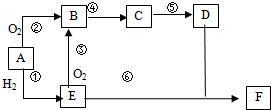
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com