


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
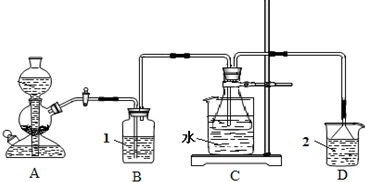
| ||
| ||
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为
2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×1010 |
| HClO | 3×10-8 |
| NH2?H2O | 1.8×10-5 |
| 难(微)溶物 | 深度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强
B.因为SiO2和CaCO3固体混合加强热时产生CO2气体,说明碳酸的酸性比硅酸酸性弱
C.SiO2既能溶于强碱溶液,又能与氢氟酸反应,故它是两性氧化物
D.因为玻璃中含SiO2,故玻璃试剂瓶不能盛装碱液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com