
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)![]() 2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
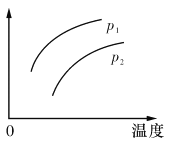
A.P1>P2,纵坐标可表示A的质量分数
B.P1<P2,纵坐标可表示C的质量贫数
C.P1>P2,纵坐标可表示混合气体的平均摩尔质量
D.P1<P2,纵坐标可表示A的转化率
【答案】C
【解析】
A、A(g)+2B(g)![]() 2C(g)△H>0,为气体体积减小且放热的可逆反应,压强增大平衡正向移动,P1>P2,压强增大平衡正向移动,A的质量分数减小,则纵坐标不能为A的质量分数,故A错误;
2C(g)△H>0,为气体体积减小且放热的可逆反应,压强增大平衡正向移动,P1>P2,压强增大平衡正向移动,A的质量分数减小,则纵坐标不能为A的质量分数,故A错误;
B、P1<P2,压强增大平衡正向移动,C的质量分数增大,P2对应的C的质量分数更大,则纵坐标不能表示C的质量贫数,故B错误;
C、由反应可知反应前后气体的总质量不变,P1>P2,压强增大平衡正向移动,气体总物质的量减小,则混合气体的平均摩尔质量增大,即压强越大,M越大,与图象相符,故C正确;
D、P1<P2,压强减小平衡逆向移动,A的转化率减小,则纵坐标不能为A的转化率,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中发生的反应的化学方程式是________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是_______。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________,该反应的离子方程式是_____________,该反应属于四种基本反应类型中的__________反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,下列有关说法正确的是( )。
A.苯可以在空气中燃烧,燃烧时产生明亮并带有浓烟的火焰
B.苯分子中含有碳碳双键,所以可使酸性高锰酸钾溶液褪色
C.苯中加入溴水,振荡后溶液分层,水层无色,说明苯与溴水发生了取代反应
D.苯与氢气催化条件下可发生加成反应,产物环己烷的二氯代物有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下图所示的操作步骤,完成Ba(OH)2·8H2O与氯化铵晶体反应的实验。
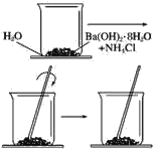
回答下列问题
(1)实验过程中观察到的现象是________________________。
(2)写出该反应的化学方程式___________________。
(3)该反应是放热反应还是吸热反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.100 mol的N2O4气体充入1 L 抽空的密闭容器中,发生如下反应:N2O4![]() 2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
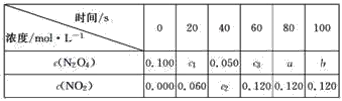
(1)达到平衡时,N2O4的转化率为______________,表中c2________c3,a________b(填“>”、“<”或“=”)。
(2)20 s时N2O4的浓度c1=________ mol·L-1,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,则要达到上述同样的平衡状态,二氧化氮的起始浓度是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是
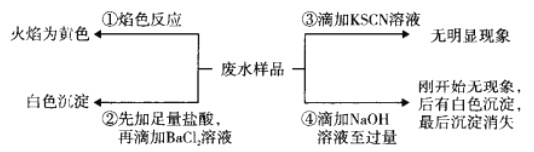
A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示. 下列有关说法正确的是

A.a、b、c 之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.若制备1 mol的CuCl2,理论上消耗11.2 LO2
D.N参加的反应离子方程式为:4Fe2++ O2+ 4H+ = 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
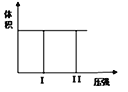
【题目】(I)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) ![]() 2Z(g), 若把2molX和1molY充入该容器时,处于状态I,反应在绝热条件下达到平衡时处于状态II(如图),则该反应的△H___0;(填:“<,>,=”)。该反应在___(填:高温或低温)条件下能自发进行。
2Z(g), 若把2molX和1molY充入该容器时,处于状态I,反应在绝热条件下达到平衡时处于状态II(如图),则该反应的△H___0;(填:“<,>,=”)。该反应在___(填:高温或低温)条件下能自发进行。
(II)已知2A2(g)+B2(g)![]() 2C(g) △H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量bkJ。请回答下列问题:
2C(g) △H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量bkJ。请回答下列问题:
(1)若将反应温度升高到700℃,反应的平衡常数将___(填“增大”、“减小”或“不变”)。
(2)若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系(用代数式表示)___。
(3)能说明该反应已经达到平衡状态的是(_____)
a.V(C)=2V(B2) b.容器内气体压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是(_____)
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d___b(填>、=、<)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸甲酯的催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式如下:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正×x(CH3COOCH3) ×x(C6H13OH),v逆=k逆×x(CH3COOC6H13) ×x(CH3OH),其中是k正、k逆为速率常数(受温度影响),x为各组分的物质的量分数。反应开始时,CH3COOCH3和C6H13OH按物质的量之比1:1投料,测得338K、343K、348K三个温度下CH3COOCH3转化率(![]() )随时间(
)随时间(![]() )的变化关系如图所示。下列说法正确的是
)的变化关系如图所示。下列说法正确的是
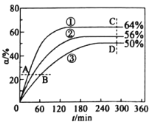
A.该反应的△H>0
B.348K时,该反应的平衡常数为1.8
C.A、B、C、D四点中,v正最大的是D
D.在曲线①、②、③中,k正与k逆的差值最大的曲线是①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com