
(10分)将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)2.24L气体的成分为: ;
(2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:
第一种情况:n(Na2O2)= mol和n(NaHCO3)= mol;
第二种情况:n(Na2O2)= mol和n(NaHCO3)= mol.
(1)O2和CO2;(2)第一种情况:n(Na2O2)= 0.16 mol和n(NaHCO3)= 0.02 mol;第二种情况:n(Na2O2)= 0.02 mol和n(NaHCO3)= 0.09 mol.
【解析】
试题分析:(1)Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,则反应后溶质为氯化钠,根据反应2Na2O2+4HCl=4NaCl+2H2O+O2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,2.24L混合气体为O2和CO2,故答案为:O2和CO2;(2)2.24L混合气体的物质的量为: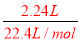 =0.1mol,2.016L气体的物质的量为:
=0.1mol,2.016L气体的物质的量为: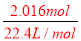 =0.09mol,
=0.09mol,
2Na2O2+2CO2=2Na2CO3+O2 △n
2 2 1
m n 0.1mol-0.09mol=0.01mol
则:n=m=0.02mol第一种情况:若CO2完全反应,则第一份生成CO2的物质的量为:0.02mol,O2的物质的量为:0.1mol-0.02mol=0.08mol,则由2Na2O2 +4HCl=4NaCl+2H2O+O2↑过氧化钠的物质的量为0.08mol 2=0.16mol;NaHCO3 +HCl=NaCl+H2O+CO2↑生成二氧化碳为0.02mol,则碳酸氢钠为0.02mol,所以Na2O2为0.16mol,NaHCO3为0.02mol;第二种情况,若CO2未完全反应,则Na2O2的物质的量为:0.02 mol,2Na2O2 +4HCl=4NaCl+2H2O+O2↑
2=0.16mol;NaHCO3 +HCl=NaCl+H2O+CO2↑生成二氧化碳为0.02mol,则碳酸氢钠为0.02mol,所以Na2O2为0.16mol,NaHCO3为0.02mol;第二种情况,若CO2未完全反应,则Na2O2的物质的量为:0.02 mol,2Na2O2 +4HCl=4NaCl+2H2O+O2↑
0.02mol 0.01mol则第一份生成O2的为0.01mol,所以CO2的物质的量为: 0.1mol-0.01mol=0.09mol,由NaHCO3 +HCl=NaCl+H2O+CO2↑,故碳酸氢钠为0.09mol所以Na2O2为0.02mol,NaHCO3为0.09mol,故答案为(2)第一种情况:n(Na2O2)= 0.16 mol和n(NaHCO3)= 0.02 mol;第二种情况:n(Na2O2)= 0.02 mol和n(NaHCO3)= 0.09 mol.
考点:钠的重要化合物


科目:高中化学 来源:2014-2015学年湖南省高三上学期12月联考化学试卷(解析版) 题型:选择题
下列表示化学反应的离子方程式正确的是
A.Na2O2与水反应:Na2O2 + H2O = 2Na+ + 2OH- + O2↑
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O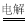 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O
D.硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三一轮复习基础知识检测化学试卷(解析版) 题型:选择题
控制适当的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断正确的是
2Fe2++I2设计成如图所示的原电池。下列判断正确的是
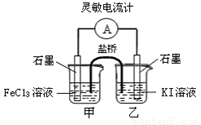
A.反应开始时,乙中电极反应为2I-+2e-== I2
B.反应开始时,甲中石墨电极上发生氧化反应
C.电流表指针为零时,两池溶液颜色相同
D.平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市四校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列溶液中溶质的物质的量浓度为1 mol/L的是
A.将58.5g NaCl固体溶于1 L水中所得溶液
B.将22.4L HCl气体溶于水配成1 L的溶液
C.从1L 10mol/L的浓盐酸中取出的100mL溶液
D.将4g NaOH固体溶于水中配成的100 mL溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市四校高一上学期期中联考化学试卷(解析版) 题型:选择题
量取10mL碘的饱和水溶液,倒入分液漏斗中,然后注入4mL四氯化碳,用力振荡后静置,实验现象为
A.液体分层,上层为四氯化碳层,黄色 B.液体分层,上层为水层,紫色
C.液体分层,下层为四氯化碳层,紫色 D.液体分层,下层为水层,黄色
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
操作1:将1 L 1.00 mol·L-1的Na2CO3溶液逐滴加入到1 L 1.25 mol·L-1的盐酸中;操作2:将1 L 1.25 mol·L-1的盐酸逐滴加入1 L 1.00 mol·L-1 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是
A.2∶5 B.5∶2 C.1∶1 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4 + 16HCl(浓) = 2KCl + 5Cl2↑ + 2MnCl2 + 8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)
A.1mol/L B.4mol/L C.2mol/L D.8mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:

(1)写出下列物质的化学式:A ,E ,戊 。
(2)F转化为C的过程中出现的现象是: 。
(3)写出②中反应的离子方程式: 。
(4)①~⑥转化中不含有氧化还原反应的是: (填序号)。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
下列反应一定属于氧化还原反应的是
A.置换反应 B.复分解反应 C.化合反应 D.分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com