
下列实验操作,现象或结论不正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | SO2通入溴水中 | 溶液褪色 | SO2有还原性 |
B | 将FeSO4样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | FeSO4样品已氧化变质 |
C | 将新制氯水和KBr溶液在试管中混合后,加入苯酚,振荡静置 | 溶液分层,下层呈橙色 | 氧化性:Cl2>Br2 |
D | 分别向0.1 mol•L-1酸酸和饱和硼酸溶液中滴加0.1 mol•L-1Na2CO3溶液 | 酸酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
科目:高中化学 来源:2015-2016学年河北省衡水市高一上第四次月考化学试卷(解析版) 题型:选择题
氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的
A.弱酸性 B.弱碱性 C.两性 D.氧化性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期12月月考化学试卷(教师版) 题型:选择题
下列各组物质全部是弱电解质的是
A.H2SiO3. H2S CO2
B.H2O NH3·H2O HClO HF
C.H2SO3. Ba(OH)2 BaSO4
D.Cu(OH)2 CH3COOH C2H5OH CH3COONa
查看答案和解析>>
科目:高中化学 来源:2016届广东省顺德市高三上第四次月考理综化学试卷(解析版) 题型:填空题
咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中。咖啡酸有止血作用,特别对内脏的止血效果较好。
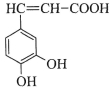
(1)咖啡酸的化学式_______。
咖啡酸中含氧官能团的名称________。
(2)咖啡酸发生加聚反应所得产物的结构简式_______。
(3)下列关于咖啡酸的说法正确的是_____:
A.1mol咖啡酸最多只能与1molBr2反应
B.咖啡酸和乙醇能发生酯化反应
C.咖啡酸遇氯化铁溶液能发生显色反应
D.只用KMnO4溶液即可检验咖啡酸分子中含有碳碳双键
(4)咖啡酸与足量NaOH溶液反应的化学方程式:_________
(5)A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式__________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:Al3+ 、NH4+ 、Cl- 、HS-
B.水电离出的C(H+)=1×10-13 mol.L-1的溶液中:Ca2+ 、HCO3- 、I- 、NO3-
C.弱酸性溶液中:Na+ 、NH4+ 、HSO3- 、Cl-
D.漂白粉的水溶液中:Fe2+ 、SO42-、 Mg2+、 Na+
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是

①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Cl2、FeCl3
A.仅有①③ B.①②③ C.仅有②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016届西藏自治区拉萨中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.维生素C具有还原性,在人体内起抗氧化作用
B.为防止月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
C.由水电离出来的c(H+)=1×10-13 mol/L的溶液中:K+、CO32-、Cl-、NO3-可能大量共存
D.使石蕊变红的溶液中:Na+、I-、Cl-、NO3-可能大量共存
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1. 0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |

下列说法正确的是
A.l0min内甲容器中反应的平均速率v(A)=0.025mol·(L·min)-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
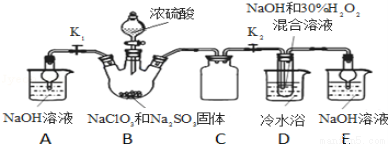
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度.测定时进行如下实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
达到滴定终点时的现象为________________。该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com