
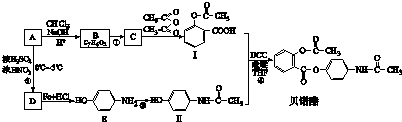
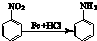
 ,红外光谱显示B中含有C-H键、O-H键、C-O键和C=O键的红外吸收峰,且B中苯环上有两个取代基,结合I的结构可知,B的结构简式为
,红外光谱显示B中含有C-H键、O-H键、C-O键和C=O键的红外吸收峰,且B中苯环上有两个取代基,结合I的结构可知,B的结构简式为 ,B发生氧化反应生成C为
,B发生氧化反应生成C为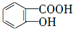 ,C中酚羟基上H原子被取代生成物质I.A发生硝化反应生成D为
,C中酚羟基上H原子被取代生成物质I.A发生硝化反应生成D为 ,D中硝基被还原为氨基生成物质E,结合物质Ⅱ的结构可知,E与乙酸反应生成物质Ⅱ,物质I与物质Ⅱ发生取代反应生成贝诺酯.
,D中硝基被还原为氨基生成物质E,结合物质Ⅱ的结构可知,E与乙酸反应生成物质Ⅱ,物质I与物质Ⅱ发生取代反应生成贝诺酯. ,红外光谱显示B中含有C-H键、O-H键、C-O键和C=O键的红外吸收峰,且B中苯环上有两个取代基,结合I的结构可知,B的结构简式为
,红外光谱显示B中含有C-H键、O-H键、C-O键和C=O键的红外吸收峰,且B中苯环上有两个取代基,结合I的结构可知,B的结构简式为 ,B发生氧化反应生成C为
,B发生氧化反应生成C为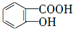 ,C中酚羟基上H原子被取代生成物质I.A发生硝化反应生成D为
,C中酚羟基上H原子被取代生成物质I.A发生硝化反应生成D为 ,D中硝基被还原为氨基生成物质E,结合物质Ⅱ的结构可知,E与乙酸反应生成物质Ⅱ,物质I与物质Ⅱ发生取代反应生成贝诺酯,
,D中硝基被还原为氨基生成物质E,结合物质Ⅱ的结构可知,E与乙酸反应生成物质Ⅱ,物质I与物质Ⅱ发生取代反应生成贝诺酯, ,分子式为C6H6O,故答案为:C6H6O;
,分子式为C6H6O,故答案为:C6H6O; ,故答案为:
,故答案为: ;
; ,
, ;
; ,
, .
.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.
连二亚硫酸钠(Na2S2O4)俗称保险粉,具有强还原性,广泛用于纺织品漂白及作脱氧剂等.查看答案和解析>>
科目:高中化学 来源: 题型:
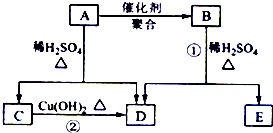 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如图所示:已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO.根据以上信息回答下列问题:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如图所示:已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2能使品红溶液褪色,是因为SO2具有漂白性 |
| B、SO2在空气中极易被氧化为SO3 |
| C、SO2通入Na2SO3或NaHCO3溶液中均能发生反应 |
| D、SO2是形成酸雨的大气污染物之一,主要来自于化石燃料的燃烧和工厂排放的废气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
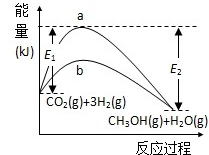 一定条件下发生反应:
一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氖气含Ne原子数为2NA |
| B、标准状况下,22.4L氨气中所含的氢原子总数为3NA |
| C、1L 1mol?L-1的盐酸中含HCl的分子数为NA |
| D、1mol由O2和CO2组成的混合气体中,含氧原子的总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com